
Wetenschap
Ontwerp van een nieuw substraat voor myogene differentiatie uit geïnduceerde pluripotente stamcellen
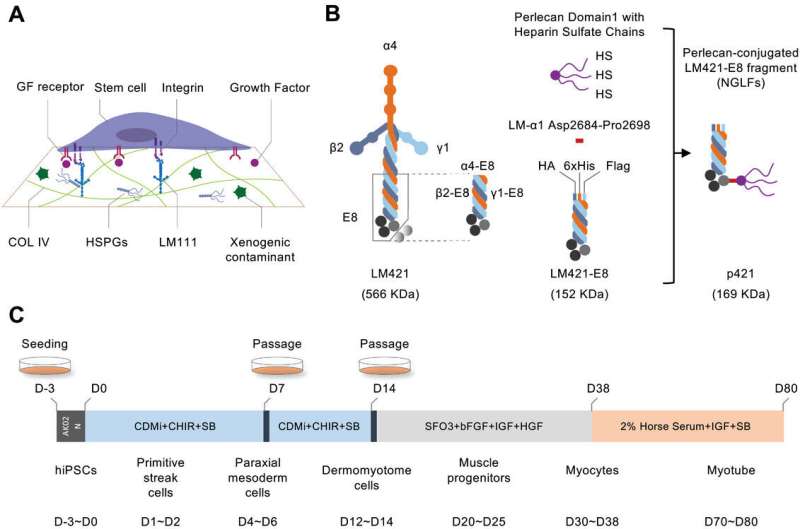
Sinds hun ontdekking hebben onderzoekers herhaaldelijk de potentiële medische toepassingen aangetoond van gedifferentieerde cellen en weefsels gegenereerd uit geïnduceerde pluripotente stamcellen (iPS). Een aanzienlijk obstakel voor medische toepassingen in de echte wereld houdt echter verband met het substraat dat wordt gebruikt om iPS-cellen te kweken en te induceren tot gedifferentieerde celtypen.
Hoewel er melding is gemaakt van differentiatieprotocollen die myocyten en spierstamcellen (MuSC's) uit iPS-cellen genereren, blijven deze relatief laag in efficiëntie en vereisen ze het gebruik van een populair, van dieren afkomstig substraat genaamd Matrigel.
In de toekomst zijn efficiëntere inductieprotocollen en een verschuiving naar xenovrije (zonder dierlijke producten) substraten die kosteneffectiviteit, reproduceerbaarheid en veiligheid kunnen garanderen noodzakelijk.
Daartoe heeft een team uit Japan hun expertise gebundeld om een nieuw recombinant extracellulair matrixeiwit te ontwerpen en valideren, genaamd nieuwe generatie lamininefragmenten (NGLFs), voor het differentiëren van iPS-cellen in spiercellijnen.
De resultaten van dit onderzoek zijn gepubliceerd in Advanced Science op 29 april 2024.
Eerdere studies hebben recombinante laminine E8 (LM-E8) fragmenten vastgesteld als een minimaal substraat voor iPS-celculturen, maar ze ondersteunen geen myogene differentiatie. Om een LM-E8-variant te identificeren die de vorming van myocyten en MuSC uit iPS-cellen kan ondersteunen, testte het team verschillende lamininen met verschillende samenstellingen, maar ontdekte dat deze slechts drastisch lagere niveaus van myogene differentiatie ondersteunden.
De onderzoekers redeneerden dat perlecan, een multifunctionele heparansulfaatproteoglycaankern (HSPG) met meerdere heparansulfaatketens in Matrigel, van vitaal belang kan zijn voor het vermogen ervan om verschillende moleculaire interacties te ondersteunen die nodig zijn voor optimaal onderhoud en differentiatie van iPS-cellen en ontwierpen daarom een LM-E8 bevestigd. naar het perlecan-domein 1 met drie HS-ketens (D1-HS).
De onderzoekers observeerden significante verbeteringen in myogene differentiatie door deze wijziging aan de C-termini van LM-E8-varianten toe te voegen. Vooral de p421-isovorm vertoonde de beste verbetering, zelfs beter dan Matrigel, dus concentreerden de onderzoekers zich op het gebruik van deze isovorm voor het genereren van myocyten en MuSC's.
Door differentiatiemarkers in verschillende stadia te onderzoeken (d.w.z. primitieve streak (PS), paraxiaal mesoderm (PM) en dermomyotoom (DM)), bevestigde het onderzoeksteam dat niet alleen NGLF's superieur zijn aan overeenkomstige LM-E8-varianten bij het bevorderen van stadiumspecifieke markergenexpressie ondersteunt p421 consistent een betere differentiatie dan alle andere geteste NGLF's.
De onderzoekers ontdekten met name dat p421 specifiek de differentiatie naar het PM-stadium ondersteunt, omdat er geen gunstige effecten werden waargenomen van p421 na PM-vorming. Bovendien hebben ze met behulp van heparitinase (om HS-ketens af te breken) en surfen (om HS-gemedieerde interacties te remmen) afgeleid dat de gunstige effecten van p421 voornamelijk afkomstig zijn van de HS-groep.
Door meerdere signaalreceptoren en hun stroomafwaartse intracellulaire effectoren te blokkeren, hebben ze bovendien vastgesteld dat p421 voornamelijk via de bFGF-FGFR-EGF-route werkt om PM-inductie te bevorderen. Analyse van genexpressie gaf verder aan dat deze signalering de HOX-genexpressie ondersteunde om ongedifferentieerde iPS-cellen naar het PS-stadium te bevorderen.
Om het belang van de conjugatie-oriëntatie tussen LM-E8 en D1-HS aan te tonen, genereerden de onderzoekers p421-varianten door het HS-gedeelte aan het N-terminale uiteinde van de β- of γ-keten van LM-E8 te hechten. Hoewel deze varianten de stadiumspecifieke merkergenexpressie verhoogden, vertoonde p421 in vergelijking aanzienlijk sterkere effecten.
Op basis van deze bevindingen concludeerde het onderzoeksteam dat p421 waarschijnlijk de FGFR-signalering helpt door HS-gebonden FGF's dichter bij het celoppervlak te brengen en zo FGFR-dimerisatie te bevorderen.
Om ten slotte te illustreren hoe p421 de myogene differentiatie verbetert en inconsistenties overwint die de huidige inductieprotocollen teisteren, heeft het onderzoeksteam ziekte- en controle-iPS-cellijnen gegenereerd voor twee vormen van spierdystrofie, Duchene spierdystrofie (DMD) en Miyoshi-myopathie (MM).
Zoals verwacht ondersteunde p421 een sterk verbeterde myogene differentiatie van alle onderzochte iPS-cellijnen. Bovendien ontdekten de onderzoekers dat p421 de myogene differentiatie verbeterde in verschillende veelgebruikte kweekmedia.
Samenvattend heeft het onderzoeksteam met succes een recombinant proteoglycaansubstraat gecreëerd dat significante verbeteringen in myogene differentiatie ondersteunt en het onderliggende mechanisme ervan gedemonstreerd.
Er wordt gehoopt dat NGLF's zullen helpen bij het opzetten van zeer efficiënte, xeno-vrije differentiatieprotocollen om van iPS-cellen afgeleide spiercellijnen te genereren voor medische toepassingen tegen verschillende myopathieën.