
Wetenschap
Hoe eiwitaggregatie plaatsvindt in cellen
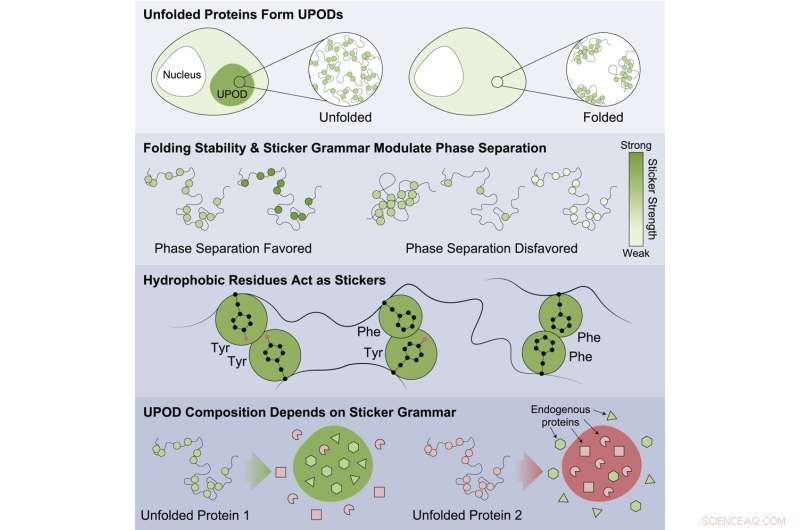
Grafisch abstract. Krediet:Moleculaire cel (2022). DOI:10.1016/j.molcel.2022.06.024
Gepubliceerd in de Molecular Cell tijdschrift op 19 juli, toonde een onderzoeksstudie van het Hatters Laboratory aan dat ongepaste eiwitaggregatie verband houdt met slechte resultaten voor de gezondheid en overleving van cellen, vooral in neuronen bij neurodegeneratieve ziekten.
De studie onderzocht de moleculaire drijvende krachten die ervoor zorgen dat verkeerd gevouwen eiwitten abnormaal aan elkaar plakken en keek naar de impact op kleverige eiwitten op de omringende eiwitten in een cel, met name hoe proteostase-systemen deze kleverige eiwitten detecteren om te voorkomen dat ze aggregeren.
Het onderzoek is het resultaat van een samenwerking tussen professor Rohit Pappu van de Washington University, onderzoekers van de University of Melbourne, waaronder Ph.D. student en gelijkwaardige eerste auteur, Yoon Hee Choi, Professor David Ascher, Dr. Dezerae Cox en Angelique Haynes en onderzoekers van de Universiteit van Leeds.
"We ontdekten dat er bepaalde eiwitten waren die normaal eiwitvouwing reguleren - moleculaire chaperonnes genoemd - die heel specifiek zijn voor het detecteren van bepaalde stickerpatronen. Dit is een belangrijke bevinding omdat het informeert hoe cellen detecteren wanneer eiwitten abnormaal aggregeren", zei professor Hatters.
Eiwitten zijn fundamenteel voor het functioneren van cellen en celoverleving en proliferatie vereist dat eiwitten zich vouwen en andere eiwitten binden.
"Wanneer eiwitten niet goed vouwen, kunnen tussenliggende 'verkeerd gevouwen' vormen - bekend als ongevouwen eiwitafzettingen (UPOD's) - aan elkaar plakken tot aggregaten. Dergelijke aggregaten ontstaan in veel ziektesituaties, wanneer de moleculaire systemen die de eiwitvouwing en -klaring regelen 'proteostase ' kapot gaan," zei Choi.
De studie benadrukte dat eiwitten die minder stabiel waren, meer kans hadden om te aggregeren en geassocieerd te worden met ziekte. Bevindingen suggereren dat dit wordt gedaan door de ongepaste aggregatie van verkeerd gevouwen formulieren met verschillende subeenheden die verschillende "sticker" -codes detecteren die de aggregatie sturen. De eiwitten zijn betrokken bij een groot aantal ziekten, waaronder kankers, aangeboren aandoeningen, ziekten van het zenuwstelsel, stofwisselingsstoornissen en huidziekten.
Er werden specifieke patronen van stickers gevonden die belangrijk waren om de aggregatie te sturen en die ervoor zorgden dat andere omringende omstander-eiwitten in de cel samenklonterden. Het werk toonde aan dat bepaalde klassen aminozuren de beste stickers waren - tyrosine en fenylalanine - en dat het patroon van de aminozuren belangrijk was voor hoe omstanders-eiwitten op ongepaste wijze werden samengevoegd en hoe moleculaire chaperonnes de gevormde aggregaten herkenden.
"De volgende stap is om de mechanismen hiervan beter te begrijpen. Dit kan nuttig zijn bij toekomstige pogingen om cellen te herprogrammeren om eiwitaggregaten beter op te ruimen, zoals bij ziekten waar ze zich op grote schaal ophopen", zei professor Hatters.
 Wetenschapsprojecten: Hoe voorkom je dat ijs smelt
Wetenschapsprojecten: Hoe voorkom je dat ijs smelt  Wetenschappers stellen voor om meta-oppervlakken van gouden nanodeeltjes te gebruiken om de moleculaire samenstelling van de stof te bepalen
Wetenschappers stellen voor om meta-oppervlakken van gouden nanodeeltjes te gebruiken om de moleculaire samenstelling van de stof te bepalen Wetenschappers synthetiseren nieuwe kunstmatige moleculen die een celmembraaneiwit nabootsen
Wetenschappers synthetiseren nieuwe kunstmatige moleculen die een celmembraaneiwit nabootsen miniatuur technologie, grote hoop op ziektedetectie
miniatuur technologie, grote hoop op ziektedetectie Het gebruik van volumetrische analyse
Het gebruik van volumetrische analyse
 Miljard jaar oude meerafzetting levert aanwijzingen voor de oude biosfeer van de aarde
Miljard jaar oude meerafzetting levert aanwijzingen voor de oude biosfeer van de aarde Industriële koolstofemissies verminderen
Industriële koolstofemissies verminderen Uitbreiding landbouwgrond vermindert CO2-opname
Uitbreiding landbouwgrond vermindert CO2-opname Hoe planten kunnen helpen bij het opruimen van residubekkens van oliezanden
Hoe planten kunnen helpen bij het opruimen van residubekkens van oliezanden Dodental cycloon Idais nu boven de 1, 000 in zuidelijk Afrika
Dodental cycloon Idais nu boven de 1, 000 in zuidelijk Afrika
Hoofdlijnen
- Experimentele evolutie:mariene roeipootkreeftjes kunnen zich genetisch aanpassen aan veranderende oceaanomstandigheden
- Top 10 mythes over de hersenen
- Suiker verstoort het microbioom, elimineert bescherming tegen obesitas en diabetes
- Soorten redeneren in geometrie
- Moderne genomica gebruiken om krokodillenschubben in vogelachtige veren te veranderen
- Slakken, slakken zijn niet de enigen die longwormziekte bij ratten veroorzaken bij mensen
- Monarchvlinders getagd met stickers in de tuin van Chicago terwijl ze naar het zuiden trekken
- Waarom vogels over grote afstanden migreren en hoe u kunt helpen tijdens hun broedseizoen
- Waarom stinkt de stinkplant?
- Hoe het herstellen van overvolle bossen meerdere uiteenlopende voordelen kan opleveren

- Kunnen we onze organen klonen voor gebruik bij een transplantatie?
- The Bioteque:een computertool om biologische kennis te harmoniseren
- Pittige Tomaten,

- Waarom creëren Britse wetenschappers een hybride mens-varken?

 Hoe een percentage van een geheel getal te berekenen
Hoe een percentage van een geheel getal te berekenen  Kinderen verdienen antwoord op hun vragen over klimaatverandering:hoe universiteiten kunnen helpen
Kinderen verdienen antwoord op hun vragen over klimaatverandering:hoe universiteiten kunnen helpen Eén gewoonte tegelijk bouwen aan een duurzame levensstijl
Eén gewoonte tegelijk bouwen aan een duurzame levensstijl Halley,
Halley,  Wat is factoring in wiskunde?
Wat is factoring in wiskunde?  GM voegt snelwegen toe aan semi-autonoom rijsysteem
GM voegt snelwegen toe aan semi-autonoom rijsysteem Braziliaanse Amazone-branden nemen toe in juli
Braziliaanse Amazone-branden nemen toe in juli Klokkenluider Cambridge Analytica roept op tot online regulering
Klokkenluider Cambridge Analytica roept op tot online regulering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

