
Wetenschap
Niet zomaar een back-up, de dubbele specificiteit van UBA6
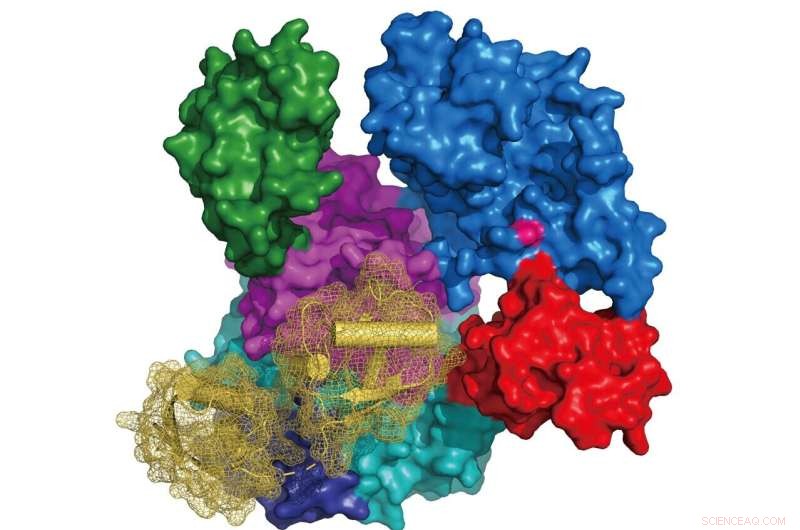
Afbeelding:Structuur van UBA6 (oppervlakteweergave gekleurd volgens zijn domeinarchitectuur, actieve site cysteïne in roze) in complex met FAT10 (lintdiagram in geel met oppervlakteweergave in mesh). Krediet:Schindelin Group
Onderzoekers van het Rudolf Virchow Center van de Universiteit van Würzburg hebben de kristalstructuren van UBA6 onthuld in een complex met ATP of het ubiquitine-achtige eiwit FAT10. Deze resultaten vormen de basis voor het bestuderen van de individuele rol van UBA6 bij de hechting van ubiquitine of FAT10 aan doeleiwitten en de stroomafwaartse cellulaire routes met mogelijke implicaties voor de etiologie van bepaalde tumoren. Deze studie is gepubliceerd in het tijdschrift Nature Communications .
Ubiquitylering van doeleiwitten is een van de belangrijkste post-translationele modificaties en speelt een essentiële rol in tal van cellulaire processen. Ubiquitylering wordt uitgevoerd door een opeenvolgende enzymatische cascade van El-activerende enzymen, E2-conjugerende enzymen en E3-ligerende enzymen. Jarenlang werd gedacht dat UBA1 het enige E1-enzym was dat ubiquitine activeert, totdat in 2007 een tweede ubiquitine-activerend enzym werd ontdekt:UBA6.
Een potentieel doelwit voor de ontwikkeling van geneesmiddelen
UBA6 is alleen aanwezig in gewervelde dieren en zee-egels. Intrigerend genoeg is UBA6 een ongebruikelijk El-enzym omdat het zowel ubiquitine als het ubiquitine-achtige eiwit (Ubl) FAT10 activeert. Vanwege het beperkte bereik van ubiquitylation-gebeurtenissen, wordt UBA6, vergeleken met de werking van het generieke ubiquitine-activerende enzym UBA1, en omdat het de enige E1-katalytische FAT10-aanhechting is, beschouwd als een potentieel geneesmiddeldoelwit. Om de gerichte remming van UAB6 verder te onderzoeken, is het essentieel om de dubbele specificiteit ervan te begrijpen en varianten van het enzym te identificeren die een stoornis hebben in de activering van ubiquitine of FAT10.
De onderzoeksgroep van Prof Hermann Schindelin aan het Rudolf Virchow Center van de Universiteit van Würzburg rapporteert de eerste structuren van UBA6, in complex met ATP of FAT10. Interessant is dat hun structurele en modelleringsstudies ook onthulden hoe UBA6 de dubbele herkenning van ubiquitine en FAT10 mogelijk maakt. Een andere belangrijke bevinding is de identificatie van UBA6-varianten die selectief de activering van ubiquitine of FAT10 afschaffen. "Deze resultaten vormen de basis voor het bestuderen van de individuele rol die UBA6 speelt bij de activering van ubiquitine of FAT10 in stroomafwaartse cellulaire routes", zegt Schindelin.
Verstrikt in verschillende ziekten
Aangezien ubiquitylering en FAT10ylering betrokken zijn bij meerdere cellulaire processen, is het niet verwonderlijk dat storingen in een of meer componenten van dit systeem leiden tot een verscheidenheid aan ziekten. Er werd gemeld dat UBA6-gemedieerde proteasomale afbraak betrokken is bij hersengeassocieerde fysiologische en pathofysiologische toestanden bij muizen. Interessant is dat UBA6 tot overexpressie werd gebracht in menselijke hersenen van patiënten met de ziekte van Alzheimer. Het tumorsuppressoreiwit p53 is een FAT10-substraat en er werd waargenomen dat een dubbel-negatieve regulatie van FAT10 en p53 cruciaal is bij de controle van tumorigenese, wat in lijn is met de overexpressie van FAT10 in veel kankerceltypen.
Hoewel voorspellingen met betrekking tot de oriëntatie van ubiquitine in complex met UBA6 gemakkelijk konden worden gegenereerd op basis van de UBA6-ATP-complexstructuur en beschikbare UBA1-Ub-structuren, leek het onmogelijk om te voorspellen hoe FAT10 en, in het bijzonder, zijn N-terminale domein ( NTD) zou interageren met UBA6. Daarom was de bepaling van de UBA6-FAT10 co-kristalstructuur een cruciale stap. Op basis van de experimenteel afgeleide structuren en het model UBA6-ubiquitinecomplex, werd een selectiviteitsschakelaar geïdentificeerd die leidde tot de daaropvolgende ontdekking van UBA6-varianten die selectief de activering van beide modifiers afschaften.
Toekomstige studies van UBA6 met de selectief gestoorde mutanten zijn nodig om mogelijke verbanden tussen UBA6-gekatalyseerde ubiquitylering en FAT10ylering in de context van kanker te onderzoeken. "Als causale verbanden kunnen worden vastgesteld, zal de gerichte remming van UBA6 door enzymatische en in silico-gebaseerde screeningbenaderingen worden uitgevoerd", legt Schindelin uit. "Met de set van mutansen die selectief ubiquitylering of FAT10ylatie aantasten, zullen we de selectieve verslechtering van beide processen onderzoeken in celgebaseerde experimenten met een bijzondere focus op kankercellen." + Verder verkennen
Team analyseert met succes de structuur van het eiwit FAT10 voor mogelijke kankertherapie
 Literatuur werpt licht op de geschiedenis en het mysterie van de Zuidelijke Oceaan
Literatuur werpt licht op de geschiedenis en het mysterie van de Zuidelijke Oceaan Nanodeeltjes van zinkoxide gebruiken als mest
Nanodeeltjes van zinkoxide gebruiken als mest Nieuwe brand ontsteekt in de buurt van LA terwijl felle bosbranden in Californië woeden
Nieuwe brand ontsteekt in de buurt van LA terwijl felle bosbranden in Californië woeden Betrouwbaar meten of rivieren of meren zonder lucht komen te zitten
Betrouwbaar meten of rivieren of meren zonder lucht komen te zitten NASA-ruimtegegevens kunnen de reactietijd bij rampen verkorten, kosten
NASA-ruimtegegevens kunnen de reactietijd bij rampen verkorten, kosten
Hoofdlijnen
- UV-licht: positieve en negatieve effecten
- Hoe haarverf bijdraagt aan het behoud van de Australische zeeleeuwenpopulatie
- Hoe slaaplabs werken
- Hoe onderhoudt een cel homeostase?
- Nieuwe soorten ontdekt in Maleisisch regenwoud tijdens ongekende, onderzoek van boven naar beneden
- The Differences in Fraternal & Paternal Twins
- Wat zijn voorbeelden van homozygote dominanten?
- 'Welke dag is het ook alweer?' De psychologie van dinsdag
- Difference Between Triglycerides & Phospholipids
- Aard-lucht warmtewisselaar beste manier om landbouwhuisdieren in stallen te beschermen tegen de gevolgen van klimaatverandering

- De 3 soorten bacteriën

- Wat kan je spit je vertellen over je DNA?
- Wat zijn de vijf belangrijkste functies van het skeletsysteem?
- Kanker-kameleons: hoe sommige agressieve kankercellen chemotherapie “hacken”
 Hoe een micro-hydroturbogenerator te bouwen
Hoe een micro-hydroturbogenerator te bouwen Aanbevelingen vergroten de kans op een MBA-aanvrager
Aanbevelingen vergroten de kans op een MBA-aanvrager Hoge verwachtingen en lage verwachtingen voor VN-klimaattop
Hoge verwachtingen en lage verwachtingen voor VN-klimaattop Kernfusie:een ster bouwen op aarde is moeilijk, daarom hebben we betere materialen nodig
Kernfusie:een ster bouwen op aarde is moeilijk, daarom hebben we betere materialen nodig Russisch vrachtschip gelanceerd naar International Space Station
Russisch vrachtschip gelanceerd naar International Space Station Great Basin zaadstudie-experiment richt zich op herstel van weidegronden
Great Basin zaadstudie-experiment richt zich op herstel van weidegronden Verlichte pyjama's verwennen pasgeborenen
Verlichte pyjama's verwennen pasgeborenen Microben vormen het toneel voor eerste dieren
Microben vormen het toneel voor eerste dieren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

