
Wetenschap
Nanoshells zouden meer chemo kunnen leveren met minder bijwerkingen
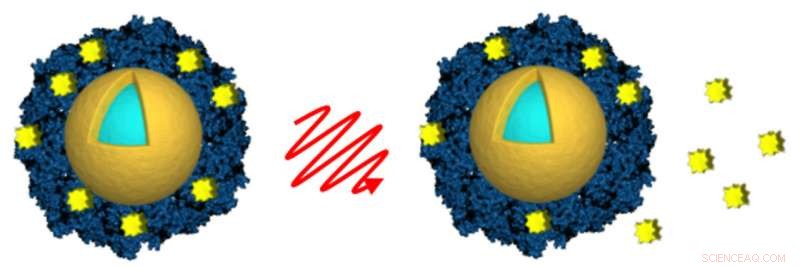
Onderzoekers van Rice University en Northwestern University laadden door licht geactiveerde nanoshells (goud en lichtblauw) met het antikankergeneesmiddel lapatinib (geel) door het medicijn in een envelop van albumine (blauw) te omhullen. Licht van een nabij-infraroodlaser (midden) werd gebruikt om op afstand de afgifte van het medicijn (rechts) te activeren nadat de nanoshells door kankercellen waren opgenomen. Krediet:A. Goodman/Rice University
Onderzoekers die manieren onderzoeken om hoge doses kankerdodende medicijnen in tumoren toe te dienen, hebben aangetoond dat ze een laser en licht-geactiveerde gouden nanodeeltjes kunnen gebruiken om op afstand de afgifte van goedgekeurde kankermedicijnen in kankercellen in laboratoriumculturen op gang te brengen.
De studie door onderzoekers van Rice University en Northwestern University Feinberg School of Medicine verschijnt deze week in de online Early Edition van de Proceedings van de National Academy of Sciences . Het gebruikte gouden nanoshells om toxische doses van twee medicijnen - lapatinib en docetaxel - in borstkankercellen af te geven. De onderzoekers toonden aan dat ze een laser konden gebruiken om de deeltjes op afstand te activeren om de medicijnen vrij te geven nadat ze de cellen waren binnengekomen.
Hoewel de tests werden uitgevoerd met celculturen in een laboratorium, het onderzoek was bedoeld om klinische toepasbaarheid aan te tonen:de nanodeeltjes zijn niet-toxisch, de medicijnen worden veel gebruikt en de low-power, infraroodlaser kan niet-invasief door weefsel schijnen en tumoren enkele centimeters onder de huid bereiken.
"In toekomstige onderzoeken we zijn van plan een Trojaanse paardenstrategie te gebruiken om de met medicijnen beladen nanoschillen in tumoren te krijgen, " zei Naomi Halas, een ingenieur, scheikundige en natuurkundige aan de Rice University die gouden nanoshells heeft uitgevonden en meer dan 15 jaar heeft besteed aan onderzoek naar hun antikankerpotentieel. "Macrofagen, een type witte bloedcel waarvan is aangetoond dat deze tumoren binnendringt, zal de geneesmiddel-deeltjescomplexen in tumoren dragen, en eenmaal daar gebruiken we een laser om de medicijnen vrij te geven."
Co-auteur Susan Clare, een universitair hoofddocent chirurgie aan de Northwestern University Feinberg School of Medicine, zei dat de PNAS-studie was ontworpen om de haalbaarheid van de Trojaanse paardenbenadering aan te tonen. Naast het aantonen dat medicijnen in kankercellen kunnen vrijkomen, de studie toonde ook aan dat in macrofagen, de medicijnen kwamen niet los voordat ze werden geactiveerd.
"Het is een hele uitdaging om chemotherapeutische medicijnen te krijgen om tumoren te penetreren, " zei Clara, ook een Northwestern Medicine-borstkankerchirurg. "Medicijnen worden eerder uit tumoren geduwd dan naar binnen gezogen. Om een effectieve dosis bij de tumor te krijgen, patiënten moeten vaak zoveel van het medicijn innemen dat misselijkheid en andere bijwerkingen ernstig worden. Onze hoop is dat de combinatie van macrofagen en getriggerde medicijnafgifte de effectieve dosis medicijnen in tumoren zal verhogen, zodat patiënten minder in plaats van meer kunnen nemen."
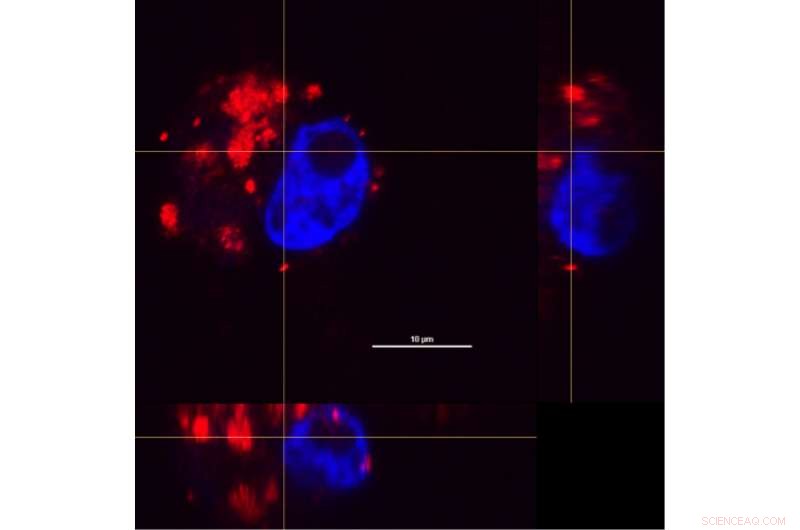
Door dwarsdoorsneden van een macrofaagcel van de x- te combineren, y- en z-assen, onderzoekers konden onderzoeken hoe nanoshell-geneesmiddelcomplexen (rood) na een incubatieperiode van 24 uur in cellen werden verdeeld. Een kleurstof werd gebruikt om de celkern (blauw) te onderscheiden. Krediet:O. Neumann/Rice University
Als de aanpak werkt, Clara zei, het kan leiden tot minder bijwerkingen en mogelijk worden gebruikt om vele soorten kanker te behandelen. Bijvoorbeeld, een van de medicijnen in de studie, lapatinib, maakt deel uit van een brede klasse van chemotherapieën die tyrosinekinaseremmers worden genoemd en die gericht zijn op specifieke eiwitten die verband houden met verschillende soorten kanker. Andere door de Federal Drug Administration goedgekeurde geneesmiddelen in de klas zijn imatinib (leukemie), gefitinib (borst, long), erlotinib (long, alvleesklier), sunitinib (maag, nier) en sorafenib (lever, schildklier en nier).
"Alle tyrosinekinaseremmers zijn notoir onoplosbaar in water, " zei Amanda Goodman, een Rice-alumna en hoofdauteur van de PNAS-studie. "Als een drugsklasse, ze hebben een slechte biologische beschikbaarheid, wat betekent dat een relatief klein deel van het medicijn in elke pil kankercellen doodt. Als onze methode werkt voor lapatinib en borstkanker, het kan ook werken voor de andere medicijnen in de klas."
Halas vond nanoshells uit bij Rice in de jaren negentig. Ongeveer 20 keer kleiner dan een rode bloedcel, ze zijn gemaakt van een bol van glas bedekt met een dun laagje goud. Nanoshells kunnen worden afgestemd om energie op te vangen van specifieke golflengten van licht, inclusief nabij-infrarood (nabij-IR), een niet-zichtbare golflengte die door de meeste weefsels in het lichaam gaat. Nanospectra Biowetenschappen, een licentiehouder van deze technologie, heeft het afgelopen decennium verschillende klinische onderzoeken uitgevoerd met nanoshells als fotothermische middelen die tumoren vernietigen met infrarood licht.
De samenwerking van Clare en Halas op het gebied van op nanoschaal gebaseerde medicijnafgifte begon meer dan 10 jaar geleden. In eerder werk, ze toonden aan dat een near-IR continue-golflaser - dezelfde soort die warmte produceert in de fotothermische toepassingen van nanoshells - kan worden gebruikt om de afgifte van medicijnen uit nanoshells te activeren.
In de laatste studie, Goodman contrasteerde het gebruik van continue-golf lasertriggering en triggering met een low-power pulslaser. Met behulp van elk type laser, ze demonstreerde de op afstand geactiveerde afgifte van medicijnen uit twee soorten nanoshell-geneesmiddelconjugaten. Eén type gebruikte een DNA-linker en het medicijn docetaxel, en de andere gebruikte een coating van het bloedeiwit albumine om lapatinib te vangen en vast te houden. In ieder geval, Goodman ontdekte dat ze de afgifte van het medicijn kon veroorzaken nadat de nanoshells in kankercellen waren opgenomen. Ze vond in beide gevallen ook geen meetbare voortijdige afgifte van medicijnen in macrofagen.
Halas en Clare zeiden dat ze hopen binnenkort met dierproeven van de technologie te beginnen en een gevestigd muismodel te hebben dat voor het testen kan worden gebruikt.
"Ik ben vooral enthousiast over het potentieel van lapatinib, ' zei Clare. 'De eerste keer dat ik over Naomi's werk hoorde, Ik vroeg me af of dit de oplossing zou kunnen zijn voor het afleveren van medicijnen in het anoxische (zuurstofarme) binnenste van tumoren waar enkele van de meest agressieve kankercellen op de loer liggen. als clinici, we zijn altijd op zoek naar manieren om te voorkomen dat kanker maanden of jaren later terugkomt, en ik heb goede hoop dat dit dat kan doen."
 Studie biedt aanwijzingen over hoe klimaat de pandemie van 1918 beïnvloedde
Studie biedt aanwijzingen over hoe klimaat de pandemie van 1918 beïnvloedde Gezondheidsbesparingen wegen zwaarder dan de kosten van het beperken van de opwarming van de aarde:studie
Gezondheidsbesparingen wegen zwaarder dan de kosten van het beperken van de opwarming van de aarde:studie Modellering van lawinebescherming in bossen
Modellering van lawinebescherming in bossen Nieuwe studie toont aan dat opslag van koolstofdioxide een veilig hulpmiddel is om klimaat te verminderen
Nieuwe studie toont aan dat opslag van koolstofdioxide een veilig hulpmiddel is om klimaat te verminderen Door klimaat veroorzaakte bosbranden eisen hun tol op tropische eilanden in de Stille Oceaan
Door klimaat veroorzaakte bosbranden eisen hun tol op tropische eilanden in de Stille Oceaan
Hoofdlijnen
- Central Dogma (Gene Expression): Definitie, Stappen, Verordening
- Theory of Evolution: Definition, Charles Darwin, Evidence & Voorbeelden
- Wat is de Western Blot-test?
- Verschillende soorten microscopen en hun gebruik
- Onderzoek suggereert dat gorilla's spontaan voedselreinigingsgedrag kunnen ontwikkelen
- Hoe werkt het spierstelsel met de bloedsomloop?
- Wetenschappelijke evaluatie van neushoorndiëten verbetert dierentuin
- Mitzi en de gigantische haarbal
- In het verleden werpen helpt de toekomst van de visserij te onthullen
- Flexibel, transparante dunnefilmtransistors wekken hoop op flexibele schermen
- Wetenschappers vinden manier om toxiciteitsniveaus voor nanodeeltjes te verlagen
- Recyclebare gezichtsmaskers met nanovezels:een zegen voor het leveringsfiasco?

- Geconstrueerde eiwitten plakken als lijm, zelfs in water

- Gerichte evolutie bouwt nanodeeltjes op

 Hoeveel waterstof heeft waterstof neutraal?
Hoeveel waterstof heeft waterstof neutraal?  Onderzoek suggereert vrouwelijk voordeel in levensverwachting gerelateerd aan fundamentele biologische wortels
Onderzoek suggereert vrouwelijk voordeel in levensverwachting gerelateerd aan fundamentele biologische wortels Wiskundigen verkrijgen nieuwe fundamentele resultaten in functionele ongelijkheden
Wiskundigen verkrijgen nieuwe fundamentele resultaten in functionele ongelijkheden Supernova-tweeling opent nieuwe mogelijkheden voor precisiekosmologie
Supernova-tweeling opent nieuwe mogelijkheden voor precisiekosmologie Wat zijn de verschillende elektrische isolatoren?
Wat zijn de verschillende elektrische isolatoren?  Satellietgegevens leggen omvang van methaanlekken bloot
Satellietgegevens leggen omvang van methaanlekken bloot Mythbusting:vijf veelvoorkomende misvattingen over de milieueffecten van plastic voor eenmalig gebruik
Mythbusting:vijf veelvoorkomende misvattingen over de milieueffecten van plastic voor eenmalig gebruik Voorspelling van seismische activiteit op frackingsites om aardbevingen te voorkomen
Voorspelling van seismische activiteit op frackingsites om aardbevingen te voorkomen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

