
Wetenschap
Onderzoekers krijgen nieuwe inzichten in de vorming van niet-pathologische amyloïden
Een team van wetenschappers van het VIB-lab van Han Remaut (VIB-VUB) en het lab van Yves Dufrêne aan de UCL Louvain-La-Neuve werkten samen aan een studie van functionele amyloïden – eiwitaggregaten met de typische amyloïdestructuur die niet tot ziekte leiden maar dienen eerder een toegewijde biologische functie. Onder leiding van Mike Sleutel (VIB-VUB), het team gebruikte een nieuwe microscopiemethode om de vorming van functionele amyloïden door bacteriën in realtime te onderzoeken, het observeren van belangrijke groei- en regulerende kenmerken die kunnen leiden tot nieuwe biomaterialen, evenals inzichten in de ontwikkeling en progressie van menselijke ziekten veroorzaakt door pathologische amyloïde plaques. Hun onderzoek is gepubliceerd in het gerenommeerde wetenschappelijke tijdschrift Natuur Chemische Biologie .
In mensen, amyloïden worden geassocieerd met neurodegeneratieve ziekten zoals de ziekte van Alzheimer, Parkinson en de ziekte van Huntington, en prionziekten zoals boviene spongiforme encefalopathie (BSE) en de ziekte van Creutzfeldt-Jakob. In deze pathologische amyloïden, eiwitten worden gevangen in een giftige vorm die celdood veroorzaakt, en leidend tot hersen- en orgaanschade en uiteindelijk de dood.
Eiwitten met een doel
Amyloïde plaques zijn samengesteld uit eiwitten of eiwitfragmenten die zich organiseren in spiraalvormige vezels die continu groeien door nieuwe moleculen aan te trekken. Eerder onderzoek heeft aangetoond dat de resulterende weefselbeschadiging bij menselijke ziekten voornamelijk wordt veroorzaakt door kleine eiwitaggregaten die worden gegenereerd tijdens de vroege stadia van amyloïdevorming. Deze moleculaire voorlopers van amyloïden zijn samengesteld uit dezelfde subeenheden, maar verschillen in structuur. bacteriën, echter, hebben het opmerkelijke vermogen om 'functionele amyloïden' te maken via een doelbewuste route waarbij geen toxische tussenproducten worden gevormd.
Prof. Dr. Han Remaut (VIB-VUB):"Het doel van dit onderzoek was om meer te weten te komen over het proces waarmee bacteriën de ontwikkeling van deze schadelijke toxische tussenproducten kunnen omzeilen. Om dit te doen, we vertrouwden op snelle atoomkrachtmicroscopie, waardoor we de groei van individuele amyloïde vezels 100 keer sneller konden observeren dan conventionele atoomkrachtmicroscopen."
Nieuwe routes creëren niet-toxische amyloïden
De wetenschappers ontdekten dat curli, een soort functionele amyloïden gecreëerd door E. coli om biofilms te vormen, een ander ontwikkelingsproces volgen dan pathologische amyloïden. Ze keken hoe curli-vezels paaien en groeien onder de atoomkrachtmicroscoop. Tijdens het kernvormende proces van amyloïde ontwikkeling, curli-subeenheden verzamelen zich in vezels van minimale grootte die onmiddellijk dezelfde eigenschappen hebben als volwassen curli.
Dr. Mike Sleutel (VIB-VUB):"Curli-vezels worden op zo'n manier gevormd dat de subeenheden zich gemakkelijk organiseren tot een minimaal amyloïde fragment zonder enige van de toxische tussentoestanden te vormen die betrokken zijn bij amyloïde ziekten. we ontdekten dat bacteriën het vermogen hebben om de groei van deze curli-vezels te reguleren door eiwitten te produceren die de plaatsen kunnen blokkeren waar binnenkomende subeenheden zouden binden."
Fascinerende toekomstige wegen
Curli zijn een ideaal modelsysteem om de verschillen tussen functionele en pathologische amyloïden te ontdekken, en te begrijpen hoe bacteriën kunnen omgaan met potentieel giftige amyloïden zonder te worden beschadigd. Nog meer, functionele amyloïden zouden kunnen dienen als toekomstige bouwstenen van nieuwe biomaterialen.
Doctoraatsstudent en co-auteur Imke Van Den Broeck (VIB-VUB):"Een interessante onderzoekspiste die we nastreven, is de productie van genetisch gemodificeerde amyloïde vezels om functionele groepen van interesse weer te geven, zoals antistoffen, enzymen, enz. Door deze benadering te gebruiken, we voorzien de vorming van zelfassemblerende nanodraden met programmeerbare functies om een nieuwe klasse van biomaterialen te creëren."
 Glycerol Vs. Mineral Oil
Glycerol Vs. Mineral Oil Onderzoek onthulde de allereerste kristalstructuur van de dopamine 2-receptor gebonden aan een antipsychoticum
Onderzoek onthulde de allereerste kristalstructuur van de dopamine 2-receptor gebonden aan een antipsychoticum Studie onthult nieuwe inzichten in hoe hybride perovskiet-zonnecellen werken
Studie onthult nieuwe inzichten in hoe hybride perovskiet-zonnecellen werken Gecombineerde databenadering kan de ontwikkeling van nieuwe materialen versnellen
Gecombineerde databenadering kan de ontwikkeling van nieuwe materialen versnellen Onderzoekers lossen een materiaalmysterie op voor elektronische apparaten van de volgende generatie
Onderzoekers lossen een materiaalmysterie op voor elektronische apparaten van de volgende generatie
 Er is genoeg dat we kunnen doen om toekomstige branden minder waarschijnlijk te maken
Er is genoeg dat we kunnen doen om toekomstige branden minder waarschijnlijk te maken Waarom wordt Zuid-Amerika getroffen door dodelijke aardverschuivingen?
Waarom wordt Zuid-Amerika getroffen door dodelijke aardverschuivingen? Waarom plastic tassen zo moeilijk te verwijderen zijn
Waarom plastic tassen zo moeilijk te verwijderen zijn Explosieve bosbranden in Californië kunnen tot december branden
Explosieve bosbranden in Californië kunnen tot december branden NASA ziet wind van buiten die nieuwe tropische depressie in de oostelijke Stille Oceaan beïnvloedt
NASA ziet wind van buiten die nieuwe tropische depressie in de oostelijke Stille Oceaan beïnvloedt
Hoofdlijnen
- Landen in de Stille Oceaan kunnen door klimaatverandering 50 - 80% van de vis in lokale wateren verliezen
- S-fase: wat gebeurt er tijdens deze subfase van de celcyclus?
- Langoustines hongeren naar kwallen gevangen op camera
- Waarom zijn de Neanderthalers uitgestorven?
- Waarom zijn chromosomen belangrijk voor celdeling?
- Maak een lijst van de stappen van de celcyclus in volgorde
- Microbiologie vs. Biochemie
- Waar vindt ademhaling plaats?
- Transcriptiefactoren en genexpressie heroverwegen
- Wetenschappers gaan nieuwe chemische neuzen maken om het milieu te ontdoen van industriële verontreinigende stoffen
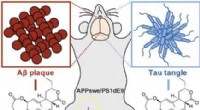
- Wortelbacterie om Alzheimer te bestrijden:Rhizolutin dissocieert bèta- en tau-aggregaten
- Hoe bondhoeken te berekenen

- Een nieuw natuurlijk blauw voor voedselkleuring

- Fosfor:350 jaar na zijn ontdekking, dit vitale element raakt op

 Natuurkundigen bepalen hoe een veelbelovend loodvrij materiaal werkt
Natuurkundigen bepalen hoe een veelbelovend loodvrij materiaal werkt Hittegolfmodel laat zien dat het op meer plaatsen vaker heter is
Hittegolfmodel laat zien dat het op meer plaatsen vaker heter is Drill-muziek biedt een levensvatbare ontsnapping voor stadsjongeren - onderzoek toont aan dat het criminaliseren ervan meer kwaad dan goed doet
Drill-muziek biedt een levensvatbare ontsnapping voor stadsjongeren - onderzoek toont aan dat het criminaliseren ervan meer kwaad dan goed doet Op weg naar onbreekbare versleutelde berichten
Op weg naar onbreekbare versleutelde berichten Europese piloten diep verontrust door mogelijke terugkeer 737 MAX
Europese piloten diep verontrust door mogelijke terugkeer 737 MAX Nieuw systeem opent de deur naar het omzetten van CO2 in industriële brandstoffen
Nieuw systeem opent de deur naar het omzetten van CO2 in industriële brandstoffen Waar vindt Fotosynthese plaats in Mossen?
Waar vindt Fotosynthese plaats in Mossen?  Maker van politiecamera's negeert implementatie van gezichtsherkenning
Maker van politiecamera's negeert implementatie van gezichtsherkenning
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | Dutch | Portuguese | German | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

