
Wetenschap
Onderzoekers karakteriseren moleculaire scharen voor plastic afval
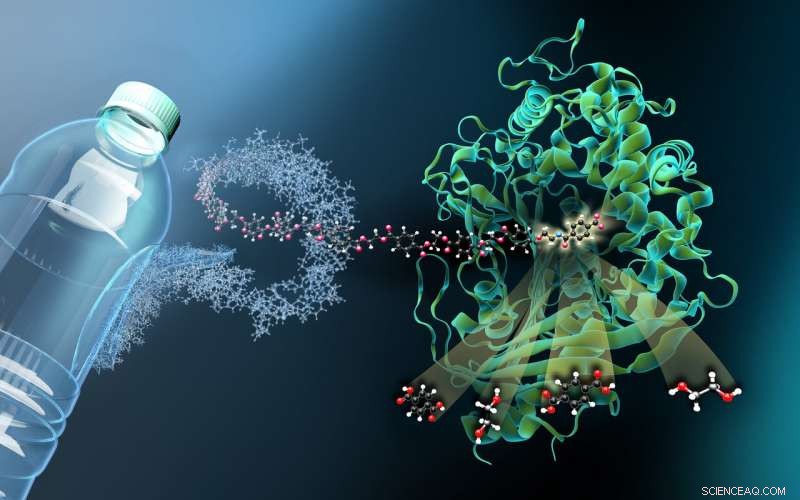
De afbeelding toont de structuur van MHETase gebonden aan een niet-hydrolyseerbaar van PET afgeleid ligand (MHETA). Symbolische polymeervezels verbinden MHETA met een typische PET-fles, wat wijst op het grote potentieel van verbeterde PETase- en MHETase-varianten in enzymatische kunststofrecycling. In dit verband, onze structurele gegevens faciliteerden het genereren van initiële MHETase-varianten met verbeterde activiteit en uitgebreide substraatspecificiteit. Onze bevindingen vormen daarmee een belangrijke stap op weg naar een verbeterd PETase/MHETase-systeem waarbij PET-recycling op een energiebesparende en duurzame manier wordt losgekoppeld van de afhankelijkheid van ruwe olie. Credit:Martin Künsting/HZB
Een onderzoeksteam van de Universiteit van Greifswald en Helmholtz-Zentrum-Berlin (HZB) heeft de moleculaire structuur van het enzym MHETase bij BESSY II opgelost. MHETase werd ontdekt in bacteriën, en samen met een tweede enzym, PETase, is in staat het veelgebruikte plastic PET op te splitsen in zijn basisbouwstenen. Met deze 3D-structuur konden de onderzoekers al een MHETase-variant met geoptimaliseerde activiteit produceren om deze te gebruiken, samen met PETase, voor een duurzame recycling van PET.
Kunststoffen zijn extreem veelzijdig en bijna eeuwig duurzaam. Maar ook dit is een probleem want na slechts ongeveer 100 jaar kunststoffen te hebben geproduceerd, plastic deeltjes zijn nu overal te vinden - in grondwater, in de oceanen, in de lucht, en in de voedselketen. Jaarlijks wordt ongeveer 50 miljoen ton van het industrieel belangrijke polymeer PET geproduceerd. Slechts een klein deel van het plastic wordt momenteel gerecycled via dure en energieverslindende processen die ofwel gedowngradede producten opleveren of op hun beurt afhankelijk zijn van het toevoegen van 'verse' ruwe olie.
in 2016, een groep Japanse onderzoekers ontdekte een bacterie die op PET groeit en zich er gedeeltelijk mee voedt. Ze ontdekten dat de bacterie twee speciale enzymen bezit, PETase en MHETase, die PET-kunststofpolymeren verteren. PETase breekt het plastic af in kleinere PET-bouwstenen, voornamelijk MHET, en MHETase splitst dit op in de twee basisvoorloperbouwstenen van PET, tereftaalzuur en ethyleenglycol. Beide componenten zijn waardevol voor het synthetiseren van nieuw PET zonder toevoeging van ruwe olie voor een gesloten duurzame productie- en terugwinningscyclus.
In april 2018, de structuur van PETase werd uiteindelijk onafhankelijk opgelost door verschillende onderzoeksgroepen. De Diamond Light Source was ook betrokken bij de experimenten. Echter, PETase is slechts een deel van de oplossing. Het is even belangrijk om de structuur van het tweede enzym te karakteriseren, MHETase.
"MHETase is aanzienlijk groter dan PETase en nog complexer. Een enkel MHETase-molecuul bestaat uit 600 aminozuren, of ongeveer 4000 atomen. MHETase heeft een oppervlak dat ongeveer twee keer zo groot is als het oppervlak van PETase en heeft daarom aanzienlijk meer potentieel voor optimalisatie naar afbraak van PET, " legt biochemicus en structureel bioloog Dr. Gert Weber van Helmholtz-Zentrum Berlin en Freie Universität Berlin uit.
Tijdens een interim-hoogleraarschap aan de Universiteit van Greifswald, Weber nam contact op met de biotechnoloog Prof. Uwe Bornscheuer van het Instituut voor Biochemie, die al bezig was met plastic afbrekende enzymen. Samen, ze ontwikkelden het idee om de structuur van MHETase op te lossen en dit inzicht vervolgens te gebruiken om het enzym te optimaliseren voor toepassingen in PET-recycling. Om dit te doen, ze moesten eerst het enzym uit bacteriecellen halen en zuiveren. Binnen deze samenwerking de teams zijn erin geslaagd de complexe driedimensionale architectuur van MHETase bij BESSY II te verkrijgen, de synchrotronbron bij HZB in Berlijn.
"Om te zien hoe MHETase aan PET bindt en het afbreekt, je hebt een stukje plastic nodig dat bindt aan MHETase maar er niet door wordt gesplitst, " legt Weber uit. Een lid van het eerdere onderzoeksteam van Weber in Greifswald, Dr. Gottfried Palm, snijd een PET-fles in stukken, heeft het PET-polymeer chemisch ontleed en er een klein chemisch fragment uit gesynthetiseerd dat bindt aan MHETase maar er niet langer door kan worden gesplitst. Van deze 'geblokkeerde' MHETase, Op de HZB werden minuscule kristallen gekweekt voor structuuronderzoek. "De structurele onderzoeken stelden ons in staat om MHETase virtueel 'aan het werk' te zien en strategieën te ontwikkelen om dit enzym te optimaliseren, " legt Weber uit.
"Dankzij het gezamenlijke onderzoeksgroepformaat, we hebben de middelen om op elk moment heel snel beamtime-toegang te bieden op de veelgevraagde BESSY II MX-bundellijnen voor metingen, " zegt Dr. Manfred Weiss, wie verantwoordelijk is voor de BESSY II MX beamlines. The three-dimensional architecture of MHETase actually displays some special features:enzymes such as MHETase bind to their target molecule first before a chemical reaction occurs. For breakdown of a molecule you need a tailor-made enzyme:"We can now exactly localise where the MHET molecule docks to MHETase and how MHET is then split into its two building blocks terephthalic acid and ethylene glycol, " says Weber.
Echter, neither PETase nor MHETase are particularly efficient. "Plastics have only been around on this scale for a few decades—even bacteria with their rapid successions of generations and rapid adaptability have not managed to develop a perfect solution through the evolutionary process of trial and error over such a short time, " explains Weber. "Thanks to the clarification of the structure of this very important enzyme, we have now also been able to plan, produce and biochemically characterise variants that show significantly higher activity than natural MHETase and are even active against another intermediate product of PET degradation, BHET, " adds Uwe Bornscheuer.
In de toekomst, Uwe Bornscheuer will work on systematically optimising the enzymes PETase and MHETase for their task—the decomposition of PET. Gert Weber plans to supplement these studies with further work on biological structures in order to systematically develop plastic-digesting enzymes for environmental applications. Access to the measuring stations and the IT infrastructure of HZB is indispensable for this.
Producing these kinds of enzymes in closed biotechnological cycles, bijvoorbeeld, could be a way to really break down PET plastics and other polymers into their basic building blocks. This would also be the key to ideal recycling and a long-term solution to the plastic waste problem:production of plastic would be a closed cycle and no longer dependent on crude oil.
De studie is gepubliceerd in Natuurcommunicatie .
 Eerdere snelle opwarmingsniveaus in het noordpoolgebied geassocieerd met wijdverbreide klimaatveranderingen
Eerdere snelle opwarmingsniveaus in het noordpoolgebied geassocieerd met wijdverbreide klimaatveranderingen Al het plastic afval kan nieuw worden, hoogwaardig kunststof door geavanceerd stoomkraken
Al het plastic afval kan nieuw worden, hoogwaardig kunststof door geavanceerd stoomkraken Scuba-duikende Kerstman brengt vakantievreugde voor vissen, museumbezoekers
Scuba-duikende Kerstman brengt vakantievreugde voor vissen, museumbezoekers Oude bergen vastgelegd in Antarctische zandsteen onthullen mogelijke verbanden met wereldwijde gebeurtenissen
Oude bergen vastgelegd in Antarctische zandsteen onthullen mogelijke verbanden met wereldwijde gebeurtenissen Schokkende hiaten in de basiskennis van het diepzeeleven
Schokkende hiaten in de basiskennis van het diepzeeleven
Hoofdlijnen
- Zijn kinderen gelukkiger dan volwassenen?
- Malawi wendt zich tot Britse troepen in stropersoorlog
- Celwand: definitie, structuur en functie (met diagram)
- Wat is lachtherapie?
- Tropische kevers worden met uitsterven bedreigd
- Wat zijn enkele kenmerken van DNA?
- Hoe nauwkeurig is ons mentale beeld van onszelf?
- Welk type RNA draagt aminozuren naar de vertaalsite?
- Stappen van DNA-transcriptie
- Met 2D-materialen kunnen elektrische voertuigen 500 mijl afleggen op één lading
- Nieuwe cyclisatiereacties voor het synthetiseren van macrocyclische medicijnleads

- Nieuwe behandelingstechnologie kan de belasting van nucleair afval in het VK verminderen
- Zeer lichtgevende inkten gemaakt van koper-jodium hybride clusters met aggregatie-geïnduceerde emissie

- Weg van plastic:het geval van solid body wash

 Voor de eerste keer, we kunnen de menselijke voetafdruk op Antarctica meten
Voor de eerste keer, we kunnen de menselijke voetafdruk op Antarctica meten ATLAS een boost geven
ATLAS een boost geven 5 manieren waarop ouders kinderen thuis kunnen motiveren tijdens de pandemie - zonder zeuren of driftbuien
5 manieren waarop ouders kinderen thuis kunnen motiveren tijdens de pandemie - zonder zeuren of driftbuien Dacht je dat de olieramp erg was? in LA, giftig afval is overal
Dacht je dat de olieramp erg was? in LA, giftig afval is overal Trio dat op het ruimtestation woonde, keert veilig terug naar de aarde
Trio dat op het ruimtestation woonde, keert veilig terug naar de aarde Socioloog roept op tot nationale verbeteringen op het gebied van strafrechtelijke rehabilitatie
Socioloog roept op tot nationale verbeteringen op het gebied van strafrechtelijke rehabilitatie Silica-paradox:wetenschappers ontdekken schijnbaar onmogelijk materiaal
Silica-paradox:wetenschappers ontdekken schijnbaar onmogelijk materiaal Ontbrekend instrument voor oceaanmonitoring gevonden na vijf jaar op zee
Ontbrekend instrument voor oceaanmonitoring gevonden na vijf jaar op zee
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

