
Wetenschap
Nieuwe CRISPR-tool richt zich op RNA in zoogdiercellen
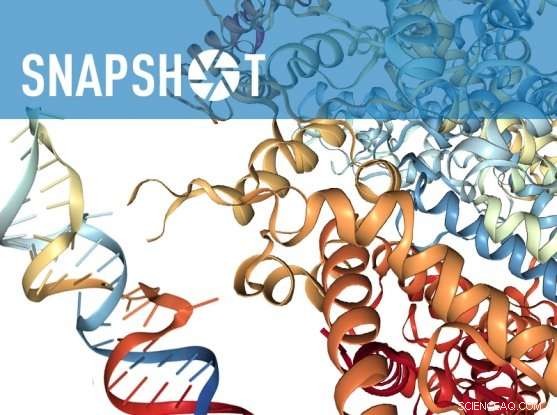
Krediet:Lauren Solomon, Brede communicatie
Onderzoekers van het Broad Institute of MIT en Harvard hebben aangetoond dat een op CRISPR gebaseerd bewerkingssysteem RNA in zoogdiercellen kan knippen en binden. In een krant deze week in Natuur , het team gebruikte CRISPR-Cas13, die de onderzoekers hadden helpen ontdekken, om zowel RNA-niveaus te verlagen als RNA's te "taggen" om ze in cellen te bekijken en te volgen. De onderzoekers gebruikten eerder CRISPR-Cas13 om RNA in bacteriële cellen te targeten, maar bewijzen dat het systeem veilig en effectief zou kunnen werken in zoogdiercellen was een cruciale stap in de richting van het gebruik van het systeem om menselijke biologie en ziekten te bestuderen.
Het hebben van dit soort programmeerbare tool voor het moduleren van RNA in zoogdiercellen creëert nieuwe mogelijkheden om te leren hoe cellen functioneren en, mogelijk, voor het ontwerpen van veiligere therapieën. In tegenstelling tot het bewerken van DNA, die permanente veranderingen aanbrengt in het genoom van een cel, het richten op RNA zou onderzoekers in staat kunnen stellen tijdelijke veranderingen aan te brengen die de hoeveelheid eiwit die door een gen wordt geproduceerd veranderen in plaats van de productie volledig te stoppen.
"Ook al hebben we goede hulpmiddelen om genen te verwijderen, ze hebben nog steeds veel beperkingen die de studie van de genfunctie moeilijk maken, " legt mede-eerste auteur Omar Abudayyeh uit, die een afgestudeerde student is in het lab van Broad kernlid en MIT-universitair hoofddocent Feng Zhang. "Met Cas13 kun je de genexpressieniveaus verlagen zonder ze volledig te elimineren, wat nuttig is voor het bestuderen van genen en mogelijk een minder giftige therapeutische benadering biedt voor het corrigeren van genetische ziekten."
Het team, geleid door wetenschappers van het laboratorium van Zhang, testte Cas13-enzymen van vijftien verschillende microben om die ene te vinden, van Leptotrichia wadei (LwaCas13a), die het meest geschikt was voor de taak. Door LwaCas13a te gebruiken, konden ze specifieke sites in gericht RNA knippen met een grotere specificiteit dan de huidige RNA-knockdown-tool of choice, RNA-interferentie (RNAi). Hoewel RNAi een handig hulpmiddel kan zijn, het leidt vaak tot ongewenste off-target effecten, experimenten moeilijk te interpreteren maken. Dergelijke off-target effecten werden significant verminderd met Cas13.
Het team van Zhang toonde ook aan dat een zogenaamde "dode" variant van Cas13 die RNA bindt maar het niet snijdt, kan worden gecombineerd met heldere fluorescerende "tags" om het doel-RNA visueel te volgen terwijl het in de cel beweegt.
"Onze engineering van Cas13 hier om transcripten te binden en af te beelden, toont de belofte van dit platform voor de ontwikkeling van een bredere set hulpmiddelen om RNA te controleren en te manipuleren, ", voegt co-eerste auteur Jonathan Gootenberg toe, die ook een afgestudeerde student is in het lab van Zhang en het lab van Broad kernlid Aviv Regev.
De onderzoekers merken op dat het aangeboren vermogen van CRISPR-Cas13 om RNA te binden het ook gemakkelijker te gebruiken maakt dan andere technologieën, die momenteel van onderzoekers vereisen dat ze het genoom van een organisme wijzigen om een bindingsplaats te creëren. Deze eigenschappen zouden van CRISPR-Cas13 een belangrijke toevoeging kunnen maken aan de gereedschapskist van biologen voor het bestuderen van de genfunctie; onderzoekers kunnen CRISPR-Cas13-tools verkrijgen via de non-profit plasmide-repository Addgene.
 Chemici ontdekken sleutel tot groenere voedselproductie
Chemici ontdekken sleutel tot groenere voedselproductie Chemici breiden genetische code van E. coli uit om 21e aminozuur te produceren, het nieuwe vaardigheden geven
Chemici breiden genetische code van E. coli uit om 21e aminozuur te produceren, het nieuwe vaardigheden geven Video:Het duizend jaar oude ei
Video:Het duizend jaar oude ei Nieuw onderzoek biedt uitgebreide inzichten in de reactie van de hersenen op opioïden
Nieuw onderzoek biedt uitgebreide inzichten in de reactie van de hersenen op opioïden Goud-fosfor-nanobladen katalyseren selectief aardgas tot groenere energie
Goud-fosfor-nanobladen katalyseren selectief aardgas tot groenere energie
 Nieuw onderzoek verklaart toekomstige effecten van de uitstoot van broeikasgassen
Nieuw onderzoek verklaart toekomstige effecten van de uitstoot van broeikasgassen De drie soorten weerfronts
De drie soorten weerfronts  Koraalriffen beschermen kusten tegen zware stormen
Koraalriffen beschermen kusten tegen zware stormen Overstromingen en tranen in Bangladesh een week na cycloon
Overstromingen en tranen in Bangladesh een week na cycloon Veranderingen in de landbouw kunnen de uitstoot van broeikasgassen die geen kooldioxide zijn, met wel 50 procent verminderen
Veranderingen in de landbouw kunnen de uitstoot van broeikasgassen die geen kooldioxide zijn, met wel 50 procent verminderen
Hoofdlijnen
- Onderzoekers testen probiotica in voeding en supplementen
- Hoefijzerkrabben bedreigd door biomedische bloedvergieten
- Zoekers in Mexico vinden, maar laat los, vaquita bruinvis kalf
- Het vreemde geval van de duikvlieg
- Waarom hebben zoveel van onze huisdieren overgewicht?
- The Differences Between Clams & Scallops
- Hoe CRISPR-genbewerking werkt
- Wat doen alle delen van een cel?
- Baanbrekende nieuwe technologie om de wereldwijde zoektocht naar gewasverbetering te versnellen
- De meeste zeeschildpadden zijn nu vrouwelijk in het noorden van het Great Barrier Reef

- Verschillen tussen lichaamscellen en neuronen
- EU-handelsverbod verlaagt wereldhandel in wilde vogels met 90 procent

- Explosie van ratten, klaverblaadjes, bedmijt, muggen onbedoeld evolutionair gevolg van verstedelijking

- Wat is kudde-immuniteit?

 WWII-onderzoeker:Zeewrak moet vliegtuig van Amerikaanse MIA-piloot zijn
WWII-onderzoeker:Zeewrak moet vliegtuig van Amerikaanse MIA-piloot zijn De verschillen tussen sprinkhanen, sprinkhanen en krekels
De verschillen tussen sprinkhanen, sprinkhanen en krekels Mijnbouw drijft het moderne leven aan, maar kan land met littekens en vervuilde wateren achterlaten
Mijnbouw drijft het moderne leven aan, maar kan land met littekens en vervuilde wateren achterlaten Bijkantoren:nieuwe familie van op goud gebaseerde nanodeeltjes zou kunnen dienen als biomedisch testbed
Bijkantoren:nieuwe familie van op goud gebaseerde nanodeeltjes zou kunnen dienen als biomedisch testbed Overwerkt en geïsoleerd:de stijgende epidemie van eenzaamheid in de academische wereld
Overwerkt en geïsoleerd:de stijgende epidemie van eenzaamheid in de academische wereld Verschillen tussen schaaldieren en insecten
Verschillen tussen schaaldieren en insecten  Klimaatgedreven temperatuurschommelingen vertragen economische groei
Klimaatgedreven temperatuurschommelingen vertragen economische groei NASA-satelliet ziet tropische cycloon Alcide naderen Madgascar
NASA-satelliet ziet tropische cycloon Alcide naderen Madgascar
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

