
Wetenschap
Wat zijn de eigenschappen van een gas?
1. Onbepaalde vorm en volume:
* Gassen nemen de vorm en het volume van hun container aan. Dit betekent dat ze geen vaste vorm of volume hebben zoals vaste stoffen.
2. Hoge samendrukbaarheid:
* Gassen worden gemakkelijk gecomprimeerd. Dit komt omdat de deeltjes in een gas ver uit elkaar liggen, waardoor grote lege ruimtes ertussen blijven. Drukkrachten deze deeltjes dichter bij elkaar.
3. Lage dichtheid:
* Gassen hebben een lage dichtheid omdat hun deeltjes zich over een groot volume verspreiden. Dit betekent dat een bepaalde hoeveelheid gas minder zal wegen dan dezelfde hoeveelheid vloeistof of vaste stof.
4. Vloeibaarheid:
* Gasmoleculen kunnen vrij voorbij elkaar stromen, waardoor ze zeer vloeiend zijn. Hierdoor kunnen gassen gemakkelijk bewegen en elke ruimte die ze innemen vullen.
5. Snelle diffusie:
* Gasdeeltjes bewegen snel en willekeurig, waardoor ze gemakkelijk in elkaar diffunderen. Dit betekent dat gassen gemakkelijk en spontaan zullen mengen.
6. Zwakke intermoleculaire krachten:
* De aantrekkelijke krachten tussen gasmoleculen zijn erg zwak. Dit komt omdat de moleculen ver uit elkaar liggen en de zwakke krachten gemakkelijk worden overwonnen door de kinetische energie van de moleculen.
7. Hoge kinetische energie:
* Gasmoleculen hebben een hoge kinetische energie, wat betekent dat ze zeer snel bewegen. Deze hoge kinetische energie geeft gassen hun karakteristieke eigenschappen.
8. Uitbreiding:
* Gassen breiden uit om hun container te vullen omdat de moleculen constant bewegen en botsen met de wanden van de container.
9. Druk:
* Gassen oefenen druk uit op hun container vanwege de botsingen van hun moleculen met de wanden. Hoe meer botsingen, hoe hoger de druk.
10. Thermische expansie:
* Gassen breiden uit wanneer ze worden verwarmd en samentrekken wanneer ze worden afgekoeld. Dit komt omdat de moleculen sneller bewegen bij hogere temperaturen, wat leidt tot meer botsingen en grotere druk.
Deze eigenschappen zijn de sleutel tot het begrijpen van het gedrag en de eigenschappen van gassen. Ze spelen ook een cruciale rol in verschillende wetenschappelijke en industriële toepassingen, zoals atmosferische wetenschap, chemische reacties en energieproductie.
 Wat is de theoretische opbrengst aan aluminiumoxide als 3,00 mol metaal wordt blootgesteld aan 2,55 mol zuurstof?
Wat is de theoretische opbrengst aan aluminiumoxide als 3,00 mol metaal wordt blootgesteld aan 2,55 mol zuurstof?  Hoeveel verbindingen kunnen koolstof en zuurstof vormen?
Hoeveel verbindingen kunnen koolstof en zuurstof vormen?  Chemicus ontwikkelt 3D-simulaties van coronavirus-spike-eiwitten
Chemicus ontwikkelt 3D-simulaties van coronavirus-spike-eiwitten Wetenschappers ontdekken een nieuw complex europiumhydride
Wetenschappers ontdekken een nieuw complex europiumhydride Goed passende brandvertragende werkkleding voor dames
Goed passende brandvertragende werkkleding voor dames
 Aanpassingen van een sabeltandtijger
Aanpassingen van een sabeltandtijger  Nieuwe vlamvertragers, oude problemen
Nieuwe vlamvertragers, oude problemen Er hangt zoveel af van een boombeschermer
Er hangt zoveel af van een boombeschermer Freak modderstromen bedreigen onze watervoorziening, en klimaatverandering verhoogt het risico
Freak modderstromen bedreigen onze watervoorziening, en klimaatverandering verhoogt het risico Kopers van woningverzekeringen hebben geen toegang tot openbare gegevens over overstromingen
Kopers van woningverzekeringen hebben geen toegang tot openbare gegevens over overstromingen
Hoofdlijnen
- Sommige eiwitten laten cellen toe om de chemische reacties binnen te regelen. Anders bieden?
- Waar in het spijsverteringssysteem zijn ziektekiemen aanwezig gedood en waarom?
- Uit onderzoek blijkt hoe de vlees- en zuivelsector de concurrentie van alternatieve dierlijke producten weerstaat
- Bijenvival:herstelt de bijenpopulatie in Texas zich?
- Hoe is variatie gunstig voor een populatie van organismen?
- Welke soort is het meest geschikt voor het leven? Allen hebben een gelijke kans, wetenschappers zeggen:
- Japanse sake:de nieuwe opkikker? Giststam maakt vermoeidheidsbestrijdende aminozuren aan
- Welke van de volgende uitspraken beschrijft het beste wat onderzoekers als eerste moeten doen om DNA te manipuleren?
- Team onthult regels voor het maken van ribben
- Nieuwe studie:stikstof vormt zeer ongebruikelijke structuren onder hoge druk

- Wetenschappers maken beelden van antilichamen die samenwerken tegen malaria
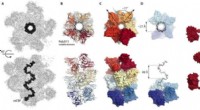
- Wetenschappers ontrafelen eiwit-nanodeeltjes interacties, pad naar drug-sensing tool voorstellen

- Het pad voor cellen verlichten

- Zo ziet een rekbaar circuit eruit
 Een nokachtige afzetting van sediment aan de rand een gletsjer?
Een nokachtige afzetting van sediment aan de rand een gletsjer?  Hoe zich te ontdoen van een variabele die is Cubed
Hoe zich te ontdoen van een variabele die is Cubed Waarom produceert koolstofdioxide en stikstof wanneer u methaan verbrandt?
Waarom produceert koolstofdioxide en stikstof wanneer u methaan verbrandt?  Wanneer twee verschillende stoffen combineren door chemische bindingen te maken, wat is het resultaat?
Wanneer twee verschillende stoffen combineren door chemische bindingen te maken, wat is het resultaat?  Boventoon en harmonischen (fysica): definitie, verschillen en frequenties
Boventoon en harmonischen (fysica): definitie, verschillen en frequenties  Heeft vloeibaar ijzer minder thermische energie of meer energie?
Heeft vloeibaar ijzer minder thermische energie of meer energie?  Industrieel gebruik voor kristallen
Industrieel gebruik voor kristallen Welke sterren komen uit de Tarantulanevel? NASA's vliegende observatorium probeert erachter te komen
Welke sterren komen uit de Tarantulanevel? NASA's vliegende observatorium probeert erachter te komen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

