
Wetenschap
Wetenschappers maken beelden van antilichamen die samenwerken tegen malaria
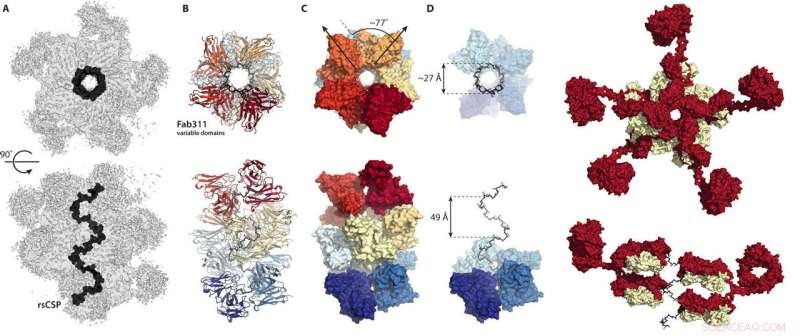
Deze cijfers uit de nieuwe wetenschappelijke vooruitgang paper laat zien hoe antilichamen zich verbinden om het circumsporozoite-eiwit van malaria in een spiraalvormige conformatie te vergrendelen. Krediet:Wilson/Ward-labs, Scripps-onderzoek
Wetenschappers die onderzoeken hoe het menselijk immuunsysteem zich verdedigt tegen malaria, hebben een zeldzaam fenomeen ontdekt:antilichamen die samenwerken om zich te binden aan een kwetsbare plek op de parasiet.
Het nieuwe onderzoek, onlangs gepubliceerd in wetenschappelijke vooruitgang , laat zien dat samenwerkende antilichamen kan resulteren in een eiwit op het celoppervlak van de parasiet dat het in een spiraalvormige conformatie vastzet, als een brede kurkentrekker, het blokkeren van de parasiet om zijn levenscyclus in de menselijke gastheer te starten en, Vandaar, beschermen tegen infectie.
"De eerste beelden waren behoorlijk opmerkelijk en gaven ons onze eerste inzichten in hoe het verlengde oppervlaktepeptide kon worden herkend, " zegt Andrew Ward, doctoraat, een Scripps Research-professor en corresponderende auteur van de studie. "CryoEM was bij uitstek geschikt om deze structuur op te lossen en opent de deur om soortgelijke oplossingen op te lossen. Om een effectief vaccin te helpen maken, we moeten de juiste manier van herkenning van dit typisch flexibele peptide door antilichamen begrijpen."
De studie maakt deel uit van een internationale inspanning om het meest geavanceerde malariavaccin te verbeteren, genaamd RTS, S, dat is in klinische onderzoeken geweest. Het kandidaat-vaccin is momenteel ongeveer 25 tot 50 procent effectief, afhankelijk van het vaccinregime, maar met honderdduizenden mensen die nog steeds elk jaar sterven aan malaria, onderzoekers zoeken naar manieren om vaccins opnieuw te ontwerpen of te herformuleren.
Om dit te doen, wetenschappers op de Californische campus van Scripps Research onderzoeken de antilichamen die het menselijk lichaam produceert wanneer het de RTS krijgt, S-vaccin. Ze zijn vooral geïnteresseerd in antilichamen die zich vroeg in zijn levenscyclus aan de malariaparasiet binden en beschermen tegen infectie - en of deze antilichamen de antilichamen nabootsen die worden geproduceerd door natuurlijke infectie.
"Als je die eerste fase bij mensen kunt blokkeren, je kunt de hele levenscyclus van de parasiet blokkeren, " zegt Jonathan Torres, onderzoeksassistent bij Scripps Research en co-eerste auteur van de studie.
Van deze beschermende antilichamen is bekend dat ze binden aan het circumsporozoïet-eiwit van malaria, het meest voorkomende eiwit op het oppervlak van de parasiet, maar niemand heeft een duidelijk beeld kunnen krijgen van hoe ze het doen. Als u begrijpt hoe deze antilichamen hun werk doen, kan dit helpen bij het ontwerpen van malariavaccins die dezelfde antilichaamrespons kunnen opwekken. Deze techniek wordt rationeel vaccinontwerp genoemd.
Met behulp van een beeldvormende techniek genaamd cryo-elektronenmicroscopie (EM), de wetenschappers kregen de eerste beelden van een antilichaam gebonden aan het circumsporozoite-eiwit. Bestudeer co-eerste auteur David Oyen, doctoraat, een onderzoeksmedewerker bij Scripps Research, zegt dat hij verrast was door wat de cryo-EM-structuren onthulden.
De vorm van het eiwit is altijd moeilijk voor te stellen vanwege een groot gebied met een lage complexiteit in het midden van het eiwit dat bestaat uit vele herhalingen van vier aminozuren die het eiwit een slappe, flexibele vorm. Oyen dacht dat antilichamen zich aan dit gebied zouden binden "als kralen aan een touwtje".
In plaats daarvan, de cryo-EM-structuren toonden het herhalingsgebied van het circumsporozoite-eiwit opgesloten in een spiraalstructuur, met 11 antilichaamfragmenten (Fab311) die uit hun bindingsplaatsen steken, die uit twee herhalingen bestaat, en tangentieel uitstralend vanuit de langwerpige spiraal.
Nog verrassender, de spiraalvormige stabiliteit wordt verleend door de contacten tussen de antilichamen. "Het is alsof ze armen met elkaar verbinden om een sterker complex te vormen, " zegt Oyen. Voor zover de wetenschappers weten, dit is de eerste keer dat de driedimensionale structuur van het herhalingsgebied van het circumsporozoite-eiwit is opgehelderd, dankzij de stabiliserende inter-antilichaamcontacten. "Het is alleen vanwege de herhalingen van meerdere sequenties op dit eiwit dat deze inter-antilichaamcontacten mogelijk zijn, ' zegt Ojeen.
"Deze structuur is erg opwindend - de herhalingssequentie van vier aminozuren op zichzelf was vele jaren geleden experimenteel gevonden om een bèta-turn te vormen en de meerdere herhalingen die voorspeld waren voor spiraalvormige structuren, maar deze structuur is heel anders dan die, omdat het een zeer brede en zeer langwerpige kurkentrekker is zoals een grote wenteltrap, " zegt Ian Wilson, DPhil, Hansen hoogleraar structurele biologie bij Scripps Research, voorzitter van de afdeling Integrative Structural and Computational Biology en co-corresponderende auteur van de studie.
Het antilichaam dat in deze studie met het circumsporozoïet-eiwit wordt getoond, is slechts een van de vele die het team van plan is af te beelden met cryo-EM. Ze hopen structuren te vergelijken om te zien of beschermende antilichamen kenmerken delen. Sommige kunnen inter-antilichaamcontacten hebben, sommigen misschien niet.
“We willen het malariavaccin zo goed mogelijk maken, " zegt Oyen. "En we hopen dat we deze cryo-EM-structuren kunnen gebruiken om nieuwe of verbeterde vaccinkandidaten te ontwerpen."
 De niveaus van Tornadoes
De niveaus van Tornadoes Grootste studie ooit van koraalgemeenschappen ontgrendelt wereldwijde oplossing om riffen te redden
Grootste studie ooit van koraalgemeenschappen ontgrendelt wereldwijde oplossing om riffen te redden Onderzoekers pakken de dringende noodzaak aan om soorten te identificeren die het meest worden bedreigd door klimaatverandering
Onderzoekers pakken de dringende noodzaak aan om soorten te identificeren die het meest worden bedreigd door klimaatverandering Met DISCO kunnen wetenschappers zeer reactief superoxide op koraalriffen meten
Met DISCO kunnen wetenschappers zeer reactief superoxide op koraalriffen meten Onderzoek naar de impact van klimaatverandering op de permafrostvoorraden in Siberië
Onderzoek naar de impact van klimaatverandering op de permafrostvoorraden in Siberië
Hoofdlijnen
- Hoe werkt het skelet met het ademhalingssysteem?
- Cellulair metabolisme: definitie, proces en de rol van ATP
- Soorten forensische tests
- Wetenschappers:woestijnschildpad bedreigd, 100 over in Arizona
- Hoe hoog kan een boom worden?
- Insecten kunnen mensen leren omgaan met tegenslag
- Slangenmans gifgewoonte houdt hoop op nieuw tegengif
- Hoe vangen cellen energie die vrijkomt door cellulaire ademhaling?
- Waarvoor gebruikt het lichaam nucleïnezuren?
- Duurzame sterk geleidende elektrodematerialen van ultradunne koolstof nanovezel aerogels afgeleid van nanofibrillated
- Medische zuurstof mag geen luxe zijn:een goedkopere manier ontwikkelen om het te produceren

- Onderzoekers ontwikkelen tools om 3D-weergave van grote RNA-moleculen te verscherpen
- Onderzoekers ontdekken een nieuwe route om complexe kristallen te vormen

- Chemische binding versus elektromagnetische golven

 NASA ziet orkaan Irmas langs de kust van Cuba
NASA ziet orkaan Irmas langs de kust van Cuba Vroegtijdige mediation leidt tot betere resultaten, studie zegt:
Vroegtijdige mediation leidt tot betere resultaten, studie zegt: Hoe maak je een diagram voor een Science Fair-project
Hoe maak je een diagram voor een Science Fair-project FAA stelt opnieuw definitieve beslissing over vergunning voor ruimtehaven in Georgië uit
FAA stelt opnieuw definitieve beslissing over vergunning voor ruimtehaven in Georgië uit Grimmig western vuurseizoen begint veel droger dan record 2020
Grimmig western vuurseizoen begint veel droger dan record 2020 Afbeelding:Nederland vanuit een baan om de aarde
Afbeelding:Nederland vanuit een baan om de aarde Weer een stap dichter bij afstembare vloeistoffen
Weer een stap dichter bij afstembare vloeistoffen Hoe de Amoeben zich reproduceren?
Hoe de Amoeben zich reproduceren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

