
Wetenschap
Waarom is de dampdruk van vaste stoffen veel lager dan die van vloeistoffen?
Daarentegen worden de deeltjes in vloeistoffen bij elkaar gehouden door zwakkere intermoleculaire krachten, waardoor ze vrijer kunnen bewegen en gemakkelijker van het oppervlak kunnen ontsnappen. Daarom hebben vloeistoffen een hogere dampdruk vergeleken met vaste stoffen.
De dampspanning van een stof houdt rechtstreeks verband met de temperatuur ervan. Naarmate de temperatuur stijgt, neemt ook de kinetische energie van de deeltjes toe, waardoor ze sneller bewegen en de intermoleculaire krachten gemakkelijker overwinnen. Dit leidt tot een verhoging van de dampspanning van zowel vaste stoffen als vloeistoffen. De dampdruk van vloeistoffen neemt echter sneller toe in vergelijking met vaste stoffen bij toenemende temperatuur als gevolg van de zwakkere intermoleculaire krachten in vloeistoffen.
Samenvattend resulteren de sterke intermoleculaire krachten in vaste stoffen vergeleken met vloeistoffen in een aanzienlijk lagere dampdruk voor vaste stoffen.
 Een efficiëntere moleculaire motor verruimt de potentiële toepassingen
Een efficiëntere moleculaire motor verruimt de potentiële toepassingen  Wiskundigen ontdekken hoe ze het klotsen kunnen stoppen met behulp van poreuze schotten
Wiskundigen ontdekken hoe ze het klotsen kunnen stoppen met behulp van poreuze schotten  Wetenschappers ontdekken nieuw bacterieel resistentiemechanisme tegen peptide-antibiotica
Wetenschappers ontdekken nieuw bacterieel resistentiemechanisme tegen peptide-antibiotica Hoe kunnen we PO4- en SO4-ionen in oplossing fosforzuur bepalen?
Hoe kunnen we PO4- en SO4-ionen in oplossing fosforzuur bepalen?  Waarom is het belangrijk dat covalente bindingen een volledige buitenste schil hebben?
Waarom is het belangrijk dat covalente bindingen een volledige buitenste schil hebben?
 Derde Pool staat voor grote veranderingen in waterstromen
Derde Pool staat voor grote veranderingen in waterstromen Zoete verbindingen helpen bij het vasthouden van water in droge grond
Zoete verbindingen helpen bij het vasthouden van water in droge grond Ongelijke mate van zeespiegelstijging gekoppeld aan klimaatverandering
Ongelijke mate van zeespiegelstijging gekoppeld aan klimaatverandering Feiten over broodvorm
Feiten over broodvorm  EPA stelt strenge emissienormen op voor zware vrachtwagens en bussen in een poging de klimaatverandering te bestrijden
EPA stelt strenge emissienormen op voor zware vrachtwagens en bussen in een poging de klimaatverandering te bestrijden
Hoofdlijnen
- Wat gebeurt er als de celcyclus niet langer gereguleerd wordt?
- Wat is een eigenschap die het resultaat is van twee dominante genen?
- Kunnen heterotrofen hun eigen voedsel maken?
- Hoe E. coli de kracht krijgt om urineweginfecties te veroorzaken
- De geplande massa-executie van ganzen in Conn. City werd stopgezet na een stortvloed aan gepassioneerde inbreng van beide kanten
- Zijn eicellen bij ouder wordende primaten beschermd tegen mutaties?
- Twee belangrijke organellen van eukaryoten die kenmerken gemeen hebben met elkaar en met bacteriën waarvan ze blijkbaar zijn afgeleid, zijn de?
- Onderzoekers passen gist aan om te laten zien hoe planten reageren op een belangrijk hormoon
- Droogte decimeert de belangrijkste katoenoogst in Texas
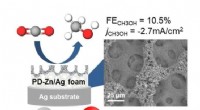
- Gas omzetten in brandstoffen met betere legeringen
- Omzetting van kooldioxide naar methanol
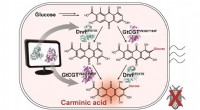
- Microbiële productie van een natuurlijke rode kleurstof karmijnzuur
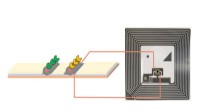
- Chemici ontwikkelen een draadloze elektronische laterale-flow-assaytest voor biosensing
- Onderzoek naar met stikstof gedoteerde polycyclische aromatische koolwaterstoffen voor hoogwaardige OLED's

 Energie majors geven 90% uit aan fossiele brandstoffen ondanks klimaatbeloften
Energie majors geven 90% uit aan fossiele brandstoffen ondanks klimaatbeloften Onderzoeker zegt dat het salaris van een vrouw de sleutel is tot het bepalen hoeveel huishoudelijk werk ze doet
Onderzoeker zegt dat het salaris van een vrouw de sleutel is tot het bepalen hoeveel huishoudelijk werk ze doet  Kan San Diegos Brain Corp. de Microsoft van zelfrijdende robots worden?
Kan San Diegos Brain Corp. de Microsoft van zelfrijdende robots worden? Radicaal ander telescoopontwerp biedt een diepere kijk in de ruimte
Radicaal ander telescoopontwerp biedt een diepere kijk in de ruimte Nieuw onderzoek identificeert Fukushima-reactormateriaal in de omgeving
Nieuw onderzoek identificeert Fukushima-reactormateriaal in de omgeving Coronaviruspandemie in Duitsland:hoe onderwijs kan slagen in tijden van crises
Coronaviruspandemie in Duitsland:hoe onderwijs kan slagen in tijden van crises Slaapgewoonten van pandemische tieners wijzen op voordelen van latere starttijden op school
Slaapgewoonten van pandemische tieners wijzen op voordelen van latere starttijden op school Schoolbereidheid getroffen door armoede, uit onderzoek blijkt
Schoolbereidheid getroffen door armoede, uit onderzoek blijkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

