
Wetenschap
De grenzen van een nieuw soort chemo verkennen
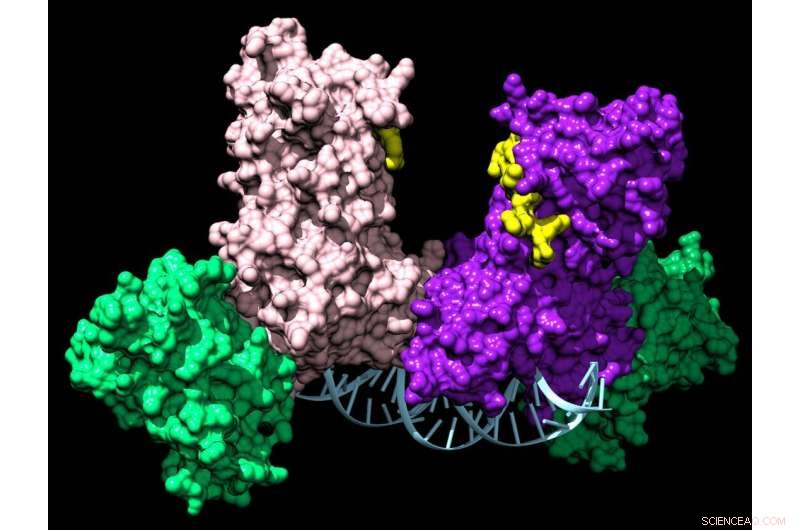
Een paar DNMT3A-enzymen voegen zich bij twee hulpeiwitten (groen) om een vierdelig complex te vormen dat langs het DNA reist en chemische tags toevoegt die een cel vertellen welke genen tot expressie moeten worden gebracht. Krediet:Jonathan Sandoval et al.
Chemotherapie zuigt. De behandelingen hebben over het algemeen vreselijke bijwerkingen, en het is geen geheim dat de betrokken medicijnen vaak giftig zijn voor zowel de patiënt als hun kanker. Het idee is dat, aangezien kankers zo snel groeien, chemotherapie de ziekte zal doden voordat de bijwerkingen de patiënt doden. Daarom zijn wetenschappers en artsen voortdurend op zoek naar effectievere therapieën.
Een team onder leiding van onderzoekers van UC Santa Barbara, en met inbegrip van medewerkers van UC San Francisco en Baylor College of Medicine, heeft twee verbindingen geïdentificeerd die krachtiger en minder toxisch zijn dan de huidige leukemietherapieën. De moleculen werken op een andere manier dan standaard kankerbehandelingen en zouden de basis kunnen vormen van een geheel nieuwe klasse geneesmiddelen. Bovendien worden de verbindingen al gebruikt voor de behandeling van andere ziekten, waardoor de administratieve rompslomp drastisch wordt verminderd om ze op leukemie af te stemmen of zelfs off-label voor te schrijven. De bevindingen verschijnen in deJournal of Medicinal Chemistry .
"Ons werk aan een enzym dat gemuteerd is bij leukemiepatiënten heeft geleid tot de ontdekking van een geheel nieuwe manier om dit enzym te reguleren, evenals tot nieuwe moleculen die effectiever en minder toxisch zijn voor menselijke cellen," zei UC Santa Barbara Distinguished Professor Norbert Reich, de corresponderende auteur van de studie.
Het epigenoom
Alle cellen in je lichaam bevatten hetzelfde DNA of genoom, maar elke cel gebruikt een ander deel van deze blauwdruk op basis van welk type cel het is. Hierdoor kunnen verschillende cellen hun gespecialiseerde functies uitvoeren terwijl ze nog steeds dezelfde handleiding gebruiken; in wezen gebruiken ze gewoon verschillende delen van de handleiding. Het epigenoom vertelt cellen hoe ze deze instructies moeten gebruiken. Chemische markeringen bepalen bijvoorbeeld welke delen worden gelezen en dicteren het werkelijke lot van een cel.
Het epigenoom van een cel wordt gekopieerd en bewaard door een enzym (een soort eiwit) genaamd DNMT1. Dit enzym zorgt er bijvoorbeeld voor dat een delende levercel verandert in twee levercellen en niet in een hersencel.
Maar zelfs bij volwassenen moeten sommige cellen differentiëren in verschillende soorten cellen dan voorheen. Beenmergstamcellen zijn bijvoorbeeld in staat om alle verschillende soorten bloedcellen te vormen, die zich niet vanzelf voortplanten. Dit wordt gecontroleerd door een ander enzym, DNMT3A.
Dit is allemaal goed en wel totdat er iets misgaat met DNMT3A, waardoor het beenmerg in abnormale bloedcellen verandert. Dit is een primaire gebeurtenis die leidt tot verschillende vormen van leukemie, evenals andere vormen van kanker.
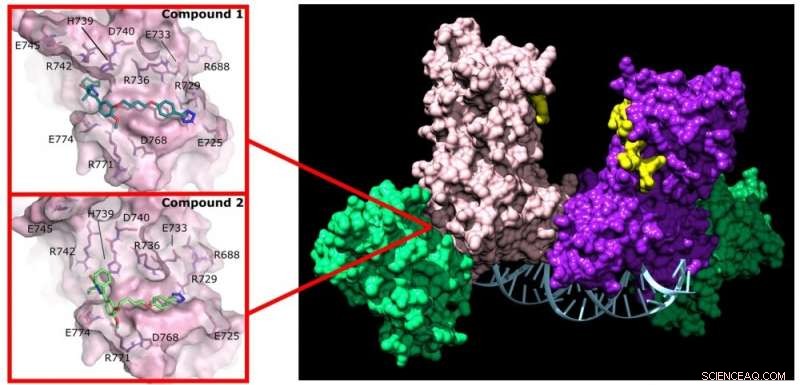
Pyrazolon (verbinding 1) en pyridazine (verbinding 2) verstoren de activiteit van DNMT3A door te binden aan een niet-actieve plaats op het enzym. Krediet:Jonathan Sandoval et al.
Giftige behandelingen
De meeste kankermedicijnen zijn ontworpen om kankercellen selectief te doden en gezonde cellen met rust te laten. Maar dit is een enorme uitdaging, en daarom zijn er zoveel extreem giftig. Huidige leukemiebehandelingen, zoals Decitabine, binden aan DNMT3A op een manier die het uitschakelt, waardoor de progressie van de ziekte wordt vertraagd. Ze doen dit door de actieve site van het enzym te verstoppen (in wezen het bedrijfsdoel) om te voorkomen dat het zijn functie uitvoert.
Helaas is de actieve site van DNMT3A vrijwel identiek aan die van DNMT1, dus het medicijn stopt de epigenetische regulatie in alle 30 tot 40 biljoen cellen van de patiënt. Dit leidt tot een van de grootste knelpunten in de geneesmiddelenindustrie:toxiciteit buiten het doel.
Het verstoppen van de actieve site van een eiwit is een eenvoudige manier om het offline te halen. Daarom is de actieve site vaak de eerste plaats waar medicijnontwerpers naar kijken bij het ontwerpen van nieuwe medicijnen, legde Reich uit. Ongeveer acht jaar geleden besloot hij echter verbindingen te onderzoeken die zich aan andere sites zouden kunnen binden in een poging om off-target effecten te voorkomen.
Samenwerken
Terwijl de groep DNMT3A aan het onderzoeken was, merkten ze iets eigenaardigs op. Hoewel de meeste van deze epigenetisch gerelateerde enzymen op zichzelf werken, vormde DNMT3A altijd complexen, hetzij met zichzelf, hetzij met partnereiwitten. Bij deze complexen kunnen meer dan 60 verschillende partners betrokken zijn, en interessant genoeg fungeren ze als homing-apparaten om DNMT3A te sturen om bepaalde genen te controleren.
Vroeg werk in het Reich-lab, geleid door voormalig afgestudeerde student Celeste Holz-Schietinger, toonde aan dat het verstoren van het complex door mutaties niet interfereerde met het vermogen om chemische markers aan het DNA toe te voegen. De DNMT3A gedroeg zich echter anders wanneer hij alleen of in een eenvoudig paar was; het was niet om op het DNA te blijven en de ene site na de andere te markeren, wat essentieel is voor zijn normale cellulaire functie.
Rond dezelfde tijd verscheen het New England Journal of Medicine deed een diepe duik in de mutaties die aanwezig zijn bij leukemiepatiënten. De auteurs van die studie ontdekten dat de meest voorkomende mutaties bij patiënten met acute myeloïde leukemie in het DNMT3A-gen zitten. Verrassend genoeg had Holz-Schietinger exact dezelfde mutaties bestudeerd. Het team had nu een directe link tussen DNMT3A en de epigenetische veranderingen die leiden tot acute myeloïde leukemie.
Een nieuwe behandeling ontdekken
Reich en zijn groep raakten geïnteresseerd in het identificeren van medicijnen die de vorming van DNMT3A-complexen in kankercellen zouden kunnen verstoren. Ze verkregen een chemische bibliotheek met 1500 eerder bestudeerde medicijnen en identificeerden er twee die DNMT3A-interacties met partnereiwitten (eiwit-eiwitremmers of PPI's) verstoren.
Bovendien binden deze twee geneesmiddelen zich niet aan de actieve plaats van het eiwit, dus ze hebben geen invloed op de DNMT1 die in alle andere lichaamscellen aan het werk is. "Deze selectiviteit is precies wat ik hoopte te ontdekken met de studenten van dit project," zei Reich.
Deze medicijnen zijn meer dan alleen een mogelijke doorbraak in de behandeling van leukemie. Het is een compleet nieuwe klasse geneesmiddelen:eiwit-eiwitremmers die een deel van het enzym weg van zijn actieve plaats richten. "Een allosterische PPI is nog nooit eerder gedaan, althans niet voor een epigenetisch medicijndoelwit," zei Reich. "Het toverde echt een glimlach op mijn gezicht toen we het resultaat kregen."
Deze prestatie is geen sinecure. "Het ontwikkelen van kleine moleculen die eiwit-eiwit-interacties verstoren, is een uitdaging gebleken", merkte hoofdauteur Jonathan Sandoval van UC San Francisco op, een voormalig doctoraatsstudent in het laboratorium van Reich. "Dit zijn de eerste gerapporteerde remmers van DNMT3A die eiwit-eiwit interacties verstoren."
De twee verbindingen die het team heeft geïdentificeerd, zijn al klinisch gebruikt voor andere ziekten. Dit elimineert veel kosten, testen en bureaucratie die nodig zijn om ze te ontwikkelen tot leukemietherapieën. In feite zouden oncologen deze medicijnen nu off-label aan patiënten kunnen voorschrijven.
Voortbouwen op succes
Er is echter nog meer te begrijpen over deze nieuwe aanpak. Het team wil meer leren over hoe eiwit-eiwitremmers DNMT3A-complexen in gezonde beenmergcellen beïnvloeden. Reich werkt samen met UC Santa Barbara scheikundeprofessor Tom Pettus en een gezamenlijke doctoraatsstudent van hen, Ivan Hernandez. "We brengen veranderingen aan in de medicijnen om te zien of we de selectiviteit en potentie nog meer kunnen verbeteren," zei Reich.
Er is ook meer te leren over de langetermijneffecten van de medicijnen. Omdat de verbindingen direct op de enzymen werken, veranderen ze mogelijk de onderliggende mutaties die de kanker veroorzaken niet. Dit voorbehoud heeft invloed op hoe artsen deze medicijnen kunnen gebruiken. "Een benadering is dat een patiënt lage doses zou blijven krijgen," zei Reich. "Als alternatief zou onze aanpak kunnen worden gebruikt met andere behandelingen, misschien om de tumorlast te verminderen tot een punt waarop stoppen met de behandeling een optie is."
Reich geeft ook toe dat het team nog moet leren welk effect de PPI's hebben op beenmergdifferentiatie op de lange termijn. Ze zijn benieuwd of de medicijnen een soort cellulair geheugen kunnen opwekken dat problemen op epigenetisch of genetisch niveau zou kunnen verminderen.
Dat gezegd hebbende, is Reich gesterkt door hun ontdekking. "Door ons niet te richten op de actieve site van DNMT3A, zijn we al een klasse verder dan het momenteel gebruikte medicijn, Decitabine, dat absoluut cytotoxisch is", zei hij, eraan toevoegend dat dit type benadering ook op andere kankers kan worden afgestemd. + Verder verkennen
Wetenschappers vinden verrassend verband tussen mitochondriaal DNA en verhoogd risico op atherosclerose
 Hoe het periodiek systeem te gebruiken
Hoe het periodiek systeem te gebruiken  Het breken van de regels van de chemie ontgrendelt een nieuwe reactie
Het breken van de regels van de chemie ontgrendelt een nieuwe reactie Het volgen van pileups op de oplaadroute van de batterij om de prestaties te verbeteren
Het volgen van pileups op de oplaadroute van de batterij om de prestaties te verbeteren Bouwen van oude gebouwen:Sloopafval wordt omgezet in nieuw beton
Bouwen van oude gebouwen:Sloopafval wordt omgezet in nieuw beton Nieuw, goedkoop alternatief voor ethyleenproductie
Nieuw, goedkoop alternatief voor ethyleenproductie
 Stikstof, fosfor uit meststoffen en uitwerpselen van huisdieren die stedelijk water vervuilen
Stikstof, fosfor uit meststoffen en uitwerpselen van huisdieren die stedelijk water vervuilen Hoe reproduceren Cheetahs?
Hoe reproduceren Cheetahs?  NASA ziet het ontwikkelen van systeem 96W van invloed op de centrale Filipijnen
NASA ziet het ontwikkelen van systeem 96W van invloed op de centrale Filipijnen Hoge niveaus van PFOA gevonden bij inwoners van midden Ohio River Valley van 1991 tot 2013
Hoge niveaus van PFOA gevonden bij inwoners van midden Ohio River Valley van 1991 tot 2013 Het weer belemmert de inspanningen om de Indonesische tsunami-vulkaan te inspecteren
Het weer belemmert de inspanningen om de Indonesische tsunami-vulkaan te inspecteren
Hoofdlijnen
- Hoe empathie werkt
- Celgroei en -deling: een overzicht van mitose en meiose
- Twee nieuwe Engelhardia-soorten van de walnootfamilie gemeld
- Studie ontwikkelt nieuwe manier om kankercellen te identificeren
- Ambien
- Het verschil van de genomische DNA-extractie tussen dier en plant
- Jackfruit uit de schappen laten springen
- Wedstrijden om vrouwelijke aandacht maken van mannen betere presteerders - in fruitvliegjes
- Maak een lijst van de 3 stappen die optreden tijdens de interfase
- Snelle en efficiënte scheiding van olie en water bereikt door nieuw ontwikkelde deeltjes

- Elektrochemie spoelt antibioticaresistente eiwitten weg

- Zelfherstellende composieten verlengen de levensduur van een product
- Oleo Sponge succesvol in echte omstandigheden voor de kust van Californië

- Een methode om kristallen te construeren met een grote fractie reactieve facetten

 De uitstoot van China overtreft nu alle ontwikkelde werelden samen
De uitstoot van China overtreft nu alle ontwikkelde werelden samen Breuken waargenomen in loopvlakken van het Mars rover-wiel
Breuken waargenomen in loopvlakken van het Mars rover-wiel Onderzoek naar regenwormen zet boeren aan tot actie
Onderzoek naar regenwormen zet boeren aan tot actie Bayer bevestigt voorspellingen terwijl de integratie van Monsanto vordert
Bayer bevestigt voorspellingen terwijl de integratie van Monsanto vordert Wetenschapper verwachtte verschijning van asteroïde sneeuwpop
Wetenschapper verwachtte verschijning van asteroïde sneeuwpop SPAD VII &SPAD XIII
SPAD VII &SPAD XIII  Nieuwe winter van ontevredenheid kan moeilijk te vermijden zijn:economisch expert over de crises waarmee Groot-Brittannië wordt geconfronteerd
Nieuwe winter van ontevredenheid kan moeilijk te vermijden zijn:economisch expert over de crises waarmee Groot-Brittannië wordt geconfronteerd Hoe het iso-elektrische punt van peptiden te berekenen
Hoe het iso-elektrische punt van peptiden te berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

