
Wetenschap
Het breken van de regels van de chemie ontgrendelt een nieuwe reactie
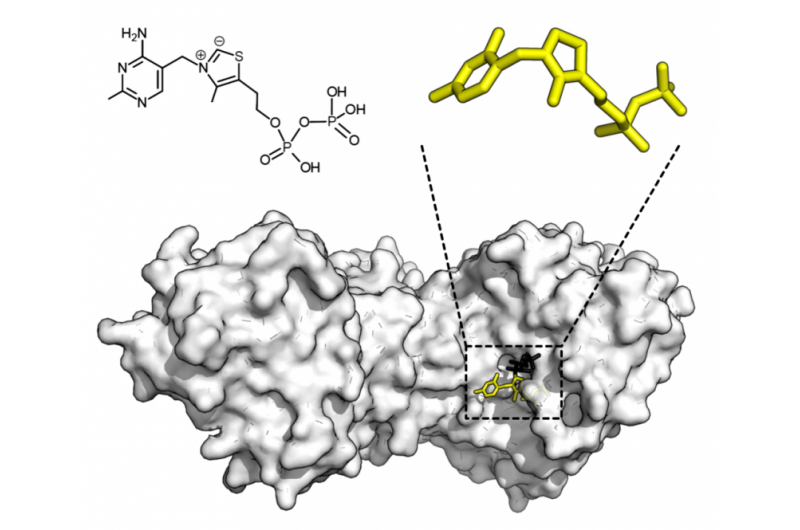
Chemische structuur voor thiaminepyrofosfaat en eiwitstructuur van transketolase. Thiamine pyrofosfaat cofactor in geel en xylulose 5-fosfaat substraat in zwart. Krediet:Thomas Shafee/Wikipedia
Wetenschappers hebben de regels van enzymengineering overtreden om een nieuwe methode te ontsluiten voor het creëren van chemische reacties die een breed scala aan nieuwe toepassingen zouden kunnen ontsluiten - van het maken van nieuwe medicijnen tot voedselproductie.
In hun artikel dat vandaag is gepubliceerd in Natuur Katalyse , Professor Francesca Paradisi en Dr. Martina Contente van de Universiteit van Nottingham en de Universiteit van Bern laten een nieuwe methode zien om chemische moleculen efficiënter te produceren door middel van een nieuwe eenstapsreactie in het enzym.
Professor Paradis is hoogleraar biokatalyse aan de School of Chemistry in Nottingham en hoogleraar Farmaceutische Chemie aan de Universiteit van Bern, legt ze uit:"We hebben aangetoond hoe een zeer eenvoudige mutatie in een van de belangrijkste residuen van een bruikbaar enzym zijn synthetische reikwijdte dramatisch heeft uitgebreid, waardoor het gebruik van de mutante variant bij de bereiding van uitdagende chemische moleculen mogelijk wordt, evenals natuurlijke metabolieten die van vitaal belang zijn in veel biologische processen in het lichaam."
Elk leerboek over enzymen zal rapporteren over hoe de katalytische aminozuren in een bepaalde enzymfamilie sterk geconserveerd zijn, ze zijn in feite een kenmerk van het soort chemie dat een enzym kan doen. Variaties komen voor en in sommige gevallen, als het vervangende aminozuur vergelijkbaar is, beide zijn in aanzienlijke mate te vinden in de natuur, maar andere kunnen veel minder vaak voorkomen en zijn slechts bij een beperkt aantal soorten te vinden.
"In deze studie hebben we een ongerept gebied van enzymtechnologie verkend en het belangrijkste katalytische residu in de actieve plaats van een enzym gewijzigd, ", voegt professor Paradisi toe. "Vroeger werd gedacht dat dit een verlies aan activiteit van het enzym zou veroorzaken, maar we hebben ontdekt dat dit niet het geval is wanneer deze biokatalysator in een synthetische richting wordt gebruikt en in feite uitdagende maar zeer bruikbare moleculen nu kunnen worden gemaakt onder milde omstandigheden die gemakkelijk kunnen worden opgeschaald en commercieel kunnen worden gerepliceerd voor gebruik in een breed scala aan producten."
Om de substraatomvang van een enzym te veranderen, is de benadering over het algemeen geweest om de residuen die betrokken zijn bij substraatherkenning te muteren, hetzij door rationeel ontwerp of gerichte evolutie, de katalysatoren altijd onaangeroerd laten.
De mutante variant van een acyltransferase-enzym werd snel gecreëerd en terwijl de natieve biokatalysator zou werken met alcoholen en lineaire aminen, de mutant werkt ook met thiolen en veel complexere aminen. Het onderzoek toonde aan dat de nieuwe variant inderdaad het vermogen om esters te hydrolyseren heeft verloren, maar voor synthetische toepassingen, waar een ester of andere functionele groepen moeten worden gemaakt (thioesters en amiden) en niet gesplitst, dit is juist een groot voordeel.
Dr. Martina Contente voegt toe, "We hebben fantastische feedback gekregen van de wetenschappelijke gemeenschap op dit onderzoek, omdat het een nieuw hulpmiddel voor chemie biedt dat kan worden toegepast op een breed scala aan moleculaire reacties. Het feit dat het een zeer stabiele reactie is die wordt gecreëerd zonder de noodzaak van specifieke omstandigheden betekent dat het het potentieel heeft voor een goedkope commerciële toepassing bij de productie van nieuwe geneesmiddelen.We geloven dat we een nieuwe combinatie hebben ontsloten in de katalytische triaden die de natuur lijkt te hebben afgekeurd, mogelijk om de controle op reactiviteit aan te scherpen, maar dat zou voor een chemicus een echte goudmijn kunnen zijn."
 De biologisch afbreekbare batterij die in 3D is geprint, wegwerp en gemaakt van papier
De biologisch afbreekbare batterij die in 3D is geprint, wegwerp en gemaakt van papier Het licht zien:onderzoekers bieden oplossing voor efficiëntieprobleem van kunstmatige fotosynthese
Het licht zien:onderzoekers bieden oplossing voor efficiëntieprobleem van kunstmatige fotosynthese Onderzoekers vinden grote lineaire negatieve thermische uitzetting in intermetallische Cr-Se-Te-verbindingen
Onderzoekers vinden grote lineaire negatieve thermische uitzetting in intermetallische Cr-Se-Te-verbindingen Speciaal blauw licht - onderzoeker ontdekt dat nieuwe chemische clusters zeer efficiënt licht uitstralen
Speciaal blauw licht - onderzoeker ontdekt dat nieuwe chemische clusters zeer efficiënt licht uitstralen Onderzoekers koppelen weesreceptor aan opioïde-geïnduceerde jeuk
Onderzoekers koppelen weesreceptor aan opioïde-geïnduceerde jeuk
 Verschillen tussen een kat, een hond en een menselijk skelet
Verschillen tussen een kat, een hond en een menselijk skelet Kustecosystemen wereldwijd:koolstofreservoirs van miljarden dollars
Kustecosystemen wereldwijd:koolstofreservoirs van miljarden dollars branden, Overstromingen vóór de vestiging hebben mogelijk de zeldzame plekken van de Amazones van vruchtbaarheid gevormd
branden, Overstromingen vóór de vestiging hebben mogelijk de zeldzame plekken van de Amazones van vruchtbaarheid gevormd Zijn klimaatwetenschappers te voorzichtig bij het koppelen van extreem weer aan klimaatverandering?
Zijn klimaatwetenschappers te voorzichtig bij het koppelen van extreem weer aan klimaatverandering? Hoe een model te bouwen Tornado
Hoe een model te bouwen Tornado
Hoofdlijnen
- Spanje meldt geval van gekkekoeienziekte
- leeuwen, chimpansees, haaien krijgen extra bescherming onder VN-verdrag
- De rol van de longen
- Studie maakt ingang naar landbouw zwanenhals zeepokken
- Hoe recombinatie-frequenties te berekenen
- Hoe zijn bacteriën en plantencellen gelijk?
- Wat is de belangrijkste primaire producent in het mariene ecosysteem?
- De structuur en functie van een cel
- Wat zijn enkele kenmerken van DNA?
- Diagnostische vooruitgang:gasgevoelige capsule komt in 2022 op de markt

- Onderzoekers vinden een manier om slijmerige biofilms zoals oude stickers af te pellen

- Het percentage opbrengst

- Histonmodificaties lezen, een oncoproteïne wordt in ruil daarvoor gewijzigd

- Valentie van elektronen in het periodiek systeem

 Video:30 jaar gaan, de ERS-1 stuurde zijn eerste afbeelding terug naar de aarde
Video:30 jaar gaan, de ERS-1 stuurde zijn eerste afbeelding terug naar de aarde Nieuw kwantumonderzoek geeft inzicht in hoe kwantumlicht kan worden beheerst
Nieuw kwantumonderzoek geeft inzicht in hoe kwantumlicht kan worden beheerst Nieuwe studie onthult waarom vrouwen sexy selfies maken
Nieuwe studie onthult waarom vrouwen sexy selfies maken Terra-satelliet ziet tropische depressie Carlotta verzwakken boven Mexico
Terra-satelliet ziet tropische depressie Carlotta verzwakken boven Mexico Wetenschappers identificeren chemische oorzaken van vervaging van batterijcapaciteit
Wetenschappers identificeren chemische oorzaken van vervaging van batterijcapaciteit Studie onthult de kwantumaard van de interactie tussen fotonen en vrije elektronen
Studie onthult de kwantumaard van de interactie tussen fotonen en vrije elektronen Afvalwaterslib omzetten in energie en minerale zouten
Afvalwaterslib omzetten in energie en minerale zouten Uit veldonderzoek blijkt dat pelletkachels de uitstoot van vervuilende stoffen met 90 procent verminderen, bijna gasfornuisprestaties
Uit veldonderzoek blijkt dat pelletkachels de uitstoot van vervuilende stoffen met 90 procent verminderen, bijna gasfornuisprestaties
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

