
Wetenschap
Een moleculaire blik op ontluikende HDL-vorming
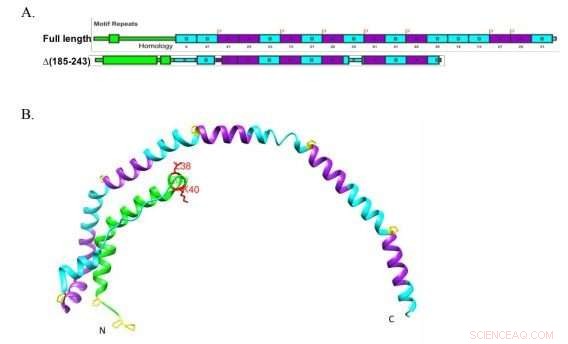
Onderzoekers van de Boston University gebruikten een ingekorte versie van Apolipoproteïne A-I, hier getoond, om definitief te bepalen dat het eiwit moet binden aan lipidetransporter ABCA1 om lipoproteïnen met hoge dichtheid te vormen, de "goede cholesterol"-deeltjes die cholesterol naar de lever transporteren voor verwijdering. Krediet:Liu et al. JLR 2018
Olie en water gaan niet samen. Maar ons waterige bloed zit vol met verschillende soorten hydrofobe lipiden, waaronder cholesterol. Om via de bloedbaan te reizen, die lipiden moeten meeliften op een amfipathische drager. In een recent artikel in de Journal of Lipid Research , wetenschappers van de Boston University melden een vooruitgang in ons mechanistische begrip van hoe zo'n drager zich vormt.
"Lipoproteïnen zijn als boten die ladingen vetstoffen van en naar onze cellen brengen en verwijderen, " zei David Atkinson, voorzitter van de afdeling fysiologie en biofysica van de Boston University School of Medicine en de senior auteur van de JLR papier.
De subset van die "boten" die cholesterol en andere lipiden vanuit andere delen van het lichaam naar de lever vervoeren, worden high-density lipoproteïnen (HDL, ook bekend als "goed cholesterol"). HDL kan cholesterol uit distale cellen verwijderen, zoals macrofagen in de wanden van slagaders, waar cholesterolophoping kan leiden tot hartaanvallen - en het aflevert aan levercellen, een proces dat bekend staat als omgekeerd cholesteroltransport. De lever voert overtollig cholesterol af door het om te zetten in galzuren die in de dunne darm worden uitgescheiden.
Volgens Atkinson, een biofysicus, het meeste van wat bekend is over de vorming van HDL komt van experimenten die een celbiologische aanpak hebben. In dat soort onderzoeken hij zei, "Je kunt (HDL-vorming) zien gebeuren, en je kunt kwantificeren wat er gebeurt, maar je begrijpt niet de drijvende interacties die ervoor zorgen dat dit gebeurt. Daar richt mijn onderzoek zich op."
HDL-deeltjes zijn gebouwd op een scaffold-eiwit dat apolipoproteïne A-I (apoA-I) wordt genoemd. Men denkt dat ApoA-I cholesterol en fosfolipiden uit het celmembraan verzamelt. Atkinson en zijn team wilden beter begrijpen hoe dat proces werkt.
ApoA-I hangt af van een lipide transporter eiwit, genaamd ABCA1, die cholesterol van het binnenste naar het buitenste blaadje van het celmembraan pompt. Omdat het cholesterol dat ABCA1 overdraagt meestal aan apoA-I wordt gebonden, sommige onderzoekers vermoedden dat er een fysieke interactie was tussen apoA-I en ABCA1. In de tussentijd, anderen voerden aan dat cholesterol en fosfolipiden net zo goed passief kunnen diffunderen en aan apoA-I kunnen binden. En de beschikbare experimenten, waarvan de meeste gebaseerd waren op verknoping, loste het debat niet op.
"Zelfs als je aantoont dat apoA-I aan het celoppervlak bindt, je weet eigenlijk niet dat het gebonden is aan ABCA1. Het is gewoon gebonden aan het celoppervlak, " legde Atkinson uit. Dus vroeg hij zijn team om te zien of ze " konden aantonen dat interactie daadwerkelijk plaatsvindt in de geïsoleerde componenten."
Het team, onder leiding van afgestudeerde student Minjing Liu, en ondersteund door Dr. Xiaohu Mei en Dr. Haya Herscovitz, gebruikte geïsoleerde apoA-I en ABCA1 om te testen op een fysieke interactie. Ze waren in staat om immunoprecipitatie van apoA-I aan te tonen met gezuiverd ABCA1.
Het lab had eerder een mutantapoA-I ontworpen met een beetje extra wiebelen in een toch al flexibel scharniergebied. Voor deze studie is ze gebruikten de mutant om aan te tonen dat een hogere flexibiliteit de apoA-I-lipidatie verhoogde, of de vorming van ontluikende HDL. Het team heeft nog niet getest of de extra flexibele mutant zich beter aan ABCA1 bindt of dat binding van een van beide vormen van apoA-I ABCA1 activeert.
Maar over één ding, Atkinson weet het zeker. "Het is de ApoA-I / ABCA1-interactie die vervolgens de ontluikende vorming van HDL-deeltjes mogelijk maakt terwijl de membraancomponenten door ABCA1 naar buiten worden getransporteerd. ' zei Atkinson.
Het verhogen van het omgekeerde cholesteroltransport kan ooit een manier zijn om atherosclerose en hartaandoeningen te verminderen. Atkinson is optimistisch over de belofte om de fysiologische processen beter te begrijpen. "Translationeel onderzoek is misschien in zwang, maar onthoud dat als je geen fundamenteel fundamenteel ontdekkingsonderzoek doet, je zult niets te vertalen hebben, " hij zei.
 Historisch klimaat belangrijk voor bodemreacties op toekomstige klimaatverandering
Historisch klimaat belangrijk voor bodemreacties op toekomstige klimaatverandering NASA ziet orkaan Helene ontkoppeld door windschering
NASA ziet orkaan Helene ontkoppeld door windschering Op de Balkan, winters gejuich wordt verduisterd door een giftige smog
Op de Balkan, winters gejuich wordt verduisterd door een giftige smog Wanneer een stip een storm beïnvloedt
Wanneer een stip een storm beïnvloedt Onderzoek verbindt terugtrekking van zee-ijs met tropische verschijnselen, inclusief een nieuw soort El Nino
Onderzoek verbindt terugtrekking van zee-ijs met tropische verschijnselen, inclusief een nieuw soort El Nino
Hoofdlijnen
- Studie identificeert waarschijnlijke scenario's voor wereldwijde verspreiding van verwoestende gewasziekte
- Onderzoekers schijnen de schijnwerpers op illegale handel in wilde orchideeën
- Studie kan strategieën opleveren om het goede cholesterol te verhogen
- Producten geproduceerd door Anaerobe ademhaling
- Nieuwe studie wijst op onverwachte voordelen van rabiësvaccinatie bij honden
- Een nieuwe kijk op toerisme en zijn bijdrage aan natuurbehoud in Nieuw-Zeeland
- Wat is een eigenschap die het resultaat is van twee dominante genen?
- Twilight-truc:er is een nieuw type cel gevonden in het oog van een diepzeevis
- Graslandmussen constant op zoek naar een mooier huis
- Onderzoekers slagen in materiaalsynthese voor hoge efficiëntie in biologische reactie

- NIR-gestuurde H2-evolutie uit water:uitbreidend golflengtebereik voor omzetting van zonne-energie
- Chemici bereiken belangrijke mijlpaal van synthese:chirale inductie op afstand
- Nieuw type plastic gemaakt van teruggewonnen afval

- De moeite waard:onderzoekers melden eerste geval van hexagonaal NaCl
 Tour de France bewust van het winnen van zijn eigen groene trui
Tour de France bewust van het winnen van zijn eigen groene trui Een betere bouwsteen voor het maken van nieuwe materialen
Een betere bouwsteen voor het maken van nieuwe materialen Componenten van Homeostasis
Componenten van Homeostasis  De rol van hydrofobe moleculen in katalytische reacties
De rol van hydrofobe moleculen in katalytische reacties Van zeewater naar zoet water door zonne-energie:een nieuwe goedkope technologie
Van zeewater naar zoet water door zonne-energie:een nieuwe goedkope technologie Engineering van een oplossing voor vuil water
Engineering van een oplossing voor vuil water Nieuwe dataminingbron voor organische materialen beschikbaar
Nieuwe dataminingbron voor organische materialen beschikbaar Risicoprofilering van nanomaterialen stelt veiligheid voorop
Risicoprofilering van nanomaterialen stelt veiligheid voorop
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

