
Wetenschap
PITT-route:wetenschappers ontdekken hoe cellen een levensduurbevorderend recyclingsysteem repareren
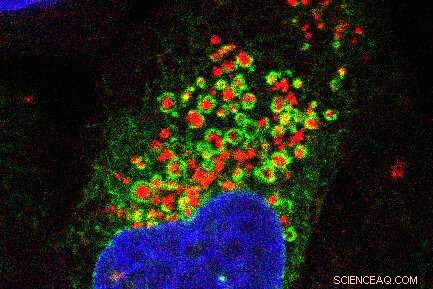
Fluorescentiemicroscopiebeelden die het endoplasmatisch reticulumnetwerk (groen) rond beschadigde lysosomen (rood) laten zien. De celkern is blauw weergegeven. Krediet:Jay Xiaojun Tan
Vandaag in Natuur , beschrijven onderzoekers van de Universiteit van Pittsburgh voor het eerst een manier waarop cellen beschadigde lysosomen repareren, structuren die bijdragen aan een lang leven door celafval te recyclen. De bevindingen zijn een belangrijke stap op weg naar het begrijpen en behandelen van leeftijdsgerelateerde ziekten veroorzaakt door lekkende lysosomen.
"Lysosoombeschadiging is een kenmerk van veroudering en veel ziekten, met name neurodegeneratieve aandoeningen zoals de ziekte van Alzheimer", zegt hoofdauteur Jay Xiaojun Tan, Ph.D., assistent-professor celbiologie aan de Pitt's School of Medicine en lid van het Aging Institute, een samenwerking tussen Pitt en UPMC. "Onze studie identificeert een reeks stappen die volgens ons een universeel mechanisme voor lysosomaal herstel zijn, die we de PITT-route hebben genoemd als een knipoog naar de Universiteit van Pittsburgh."
Als het recyclingsysteem van de cel bevatten lysosomen krachtige spijsverteringsenzymen die moleculair afval afbreken. Deze inhoud is afgeschermd tegen beschadiging van andere delen van de cel met een membraan dat werkt als een hekwerk rond een faciliteit voor gevaarlijk afval. Hoewel in dit hek breuken kunnen optreden, herstelt een gezonde cel de schade snel. Om meer te weten te komen over dit reparatieproces, werkte Tan samen met senior auteur Toren Finkel, M.D., Ph.D., directeur van het Aging Institute en vooraanstaand professor in de geneeskunde aan de Pitt's School of Medicine.
Ten eerste beschadigde Tan experimenteel lysosomen in in het laboratorium gekweekte cellen en mat vervolgens de eiwitten die ter plaatse kwamen. Hij ontdekte dat een enzym genaamd PI4K2A zich binnen enkele minuten op beschadigde lysosomen ophoopte en hoge niveaus van een signaalmolecuul genaamd PtdIns4P genereerde.
"PtdIns4P is als een rode vlag. Het vertelt de cel:'Hé, we hebben hier een probleem'", zei Tan. "Dit waarschuwingssysteem werft dan een andere groep eiwitten aan, ORP's genaamd."
ORP-eiwitten werken als kettingen, legde Tan uit. Het ene uiteinde van het eiwit bindt aan de rode vlag PtdIns4P op het lysosoom en het andere uiteinde bindt aan het endoplasmatisch reticulum, de celstructuur die betrokken is bij de synthese van eiwitten en lipiden.
"Het endoplasmatisch reticulum wikkelt zich als een deken om het lysosoom", voegde Finkel eraan toe. "Normaal gesproken raken het endoplasmatisch reticulum en de lysosomen elkaar nauwelijks, maar toen het lysosoom eenmaal beschadigd was, ontdekten we dat ze elkaar omhelsden."
Door deze omhelzing worden cholesterol en een lipide genaamd fosfatidylserine naar het lysosoom gependeld en helpen gaten in de membraanomheining te dichten.
Fosfatidylserine activeert ook een eiwit genaamd ATG2, dat fungeert als een brug om andere lipiden naar het lysosoom over te brengen, de laatste membraanreparatiestap in de nieuw beschreven door PITT of fosfoinositide geïnitieerde membraantethering en lipidetransportroute.
"Het mooie aan dit systeem is dat het bekend was dat alle componenten van de PITT-route bestonden, maar dat ze niet in deze volgorde interageren of voor de functie van lysosoomreparatie", zei Finkel. "Ik geloof dat deze bevindingen veel implicaties zullen hebben voor normale veroudering en voor aan leeftijd gerelateerde ziekten."
De onderzoekers vermoeden dat bij gezonde mensen kleine breukjes in het lysosoommembraan snel hersteld worden via de PITT-route. Maar als de schade te groot is of als het herstelpad in gevaar komt - als gevolg van leeftijd of ziekte - hopen zich lekkende lysosomen op. Bij de ziekte van Alzheimer is lekkage van tau-fibrillen uit beschadigde lysosomen een belangrijke stap in de progressie van de ziekte.
Toen Tan het gen verwijderde dat codeert voor het eerste enzym in de route, PI4K2A, ontdekte hij dat de verspreiding van tau-fibrillen dramatisch toenam, wat suggereert dat defecten in de PITT-route zouden kunnen bijdragen aan de progressie van de ziekte van Alzheimer. In toekomstig werk zijn de onderzoekers van plan muismodellen te ontwikkelen om te begrijpen of de PITT-route muizen kan beschermen tegen het ontwikkelen van de ziekte van Alzheimer. + Verder verkennen
Onderzoekers voeren metabolomische profilering uit van individuele vergrote lysosomen
 Nieuwe keramische nanovezelsponzen kunnen worden gebruikt voor flexibele isolatie, water Zuivering
Nieuwe keramische nanovezelsponzen kunnen worden gebruikt voor flexibele isolatie, water Zuivering Stimulatie van kleine gebieden op celoppervlakken met vrije radicalen met behulp van een microfluïdische sonde
Stimulatie van kleine gebieden op celoppervlakken met vrije radicalen met behulp van een microfluïdische sonde Energie opwekken uit vervuilde lucht
Energie opwekken uit vervuilde lucht Reparatie van kuilen milieuvriendelijk gemaakt met gruis van afvalwaterzuivering
Reparatie van kuilen milieuvriendelijk gemaakt met gruis van afvalwaterzuivering Voor fotokatalysatoren, de tand des tijds doorstaan betekent een perfecte partner vinden
Voor fotokatalysatoren, de tand des tijds doorstaan betekent een perfecte partner vinden
 De rol van algen in de landbouw
De rol van algen in de landbouw Waarom een netto-nul toekomst afhangt van het vermogen van de oceanen om koolstof te absorberen
Waarom een netto-nul toekomst afhangt van het vermogen van de oceanen om koolstof te absorberen De verbinding tussen zonnecyclus en winterweer in de Noord-Atlantische Oceaan ontkrachten
De verbinding tussen zonnecyclus en winterweer in de Noord-Atlantische Oceaan ontkrachten Japan veerkrachtig, maar klimaatverandering maakt rampen erger:experts
Japan veerkrachtig, maar klimaatverandering maakt rampen erger:experts Wetenschappers ontwikkelen kader voor duurzaam beleggen
Wetenschappers ontwikkelen kader voor duurzaam beleggen
Hoofdlijnen
- Nurture to Nature: hoe uw opvoeding uw hersenen kan beïnvloeden
- Gekapte tropische regenwouden ondersteunen nog steeds de biodiversiteit, zelfs als de hitte aan staat
- Wat zijn de tien kenmerken van levende organismen?
- Hoe u kunt helpen haaien te beschermen en wat niet werkt
- Cheerleading Science Fair Project Ideas
- Oorsmeer zoals ijskernen - ontsluiten het verleden verborgen in oordopjes voor walvissen
- De vierkantswortel vinden op een Texas Instrument TI-30X IIS
- Soorten organismen die van plantencellen zijn gemaakt
- Opwarming van de oceaan signaleert verandering van dieet voor Europese aalscholvers
- Wereldwijd belang van honingbijen voor natuurlijke habitats vastgelegd in nieuw rapport

- Kwaliteitsborging voor nieuwe stamcellen:macrofagen doen het onderzoek
- Wetenschappers tonen moleculaire basis voor mieren die als lijfwachten voor planten fungeren

- Verschillen tussen "Fysiek" en "Fysiologisch"
- Waarom zingen mensen onder de douche?

 Oude olievelden zijn mogelijk minder vatbaar voor geïnduceerde aardbevingen
Oude olievelden zijn mogelijk minder vatbaar voor geïnduceerde aardbevingen Het wijnland van Californië staat voor een lange strijd als het vuur explodeert
Het wijnland van Californië staat voor een lange strijd als het vuur explodeert Verwoesting:bosbranden verwoesten het westen van de Verenigde Staten
Verwoesting:bosbranden verwoesten het westen van de Verenigde Staten Een studie analyseert de groei en ontwikkeling van de diploïsche aderen bij moderne mensen
Een studie analyseert de groei en ontwikkeling van de diploïsche aderen bij moderne mensen Redenen om een milieuvriendelijk huis te bouwen
Redenen om een milieuvriendelijk huis te bouwen Hoe maak je een zelfgemaakte hygrometer
Hoe maak je een zelfgemaakte hygrometer  Het aantal sterfgevallen door luchtvervuiling in de VS is tussen 1990 en 2010 bijna gehalveerd
Het aantal sterfgevallen door luchtvervuiling in de VS is tussen 1990 en 2010 bijna gehalveerd Wat is de meest giftige spin voor mensen?
Wat is de meest giftige spin voor mensen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

