
Wetenschap
Immuunfunctie geremodelleerd door mitochondriale vorm
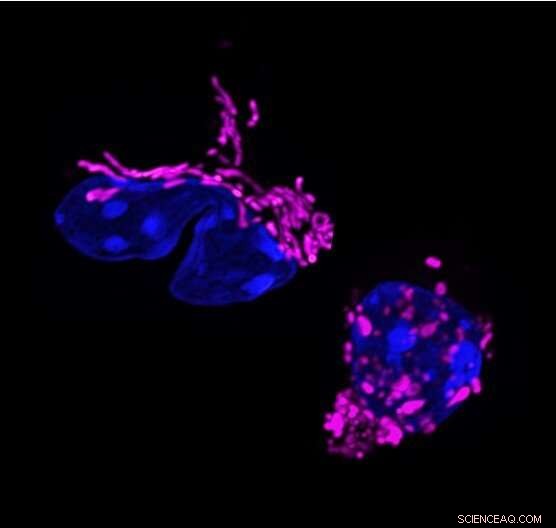
Mitochondriale vormverandering in de T-celrespons. Dynamische veranderingen in mitochondriale vorm koppelen aan T-celfunctie. T-helper 17-cellen vertonen langwerpige mitochondriën (paars gekleurd, links). Eliminatie van het mitochondriale membraanvormende eiwit OPA1, fragmenteert mitochondriën in T-cellen (rechts) en verandert de T-celrespons. Krediet:Francesc Baixauli
Een nieuwe studie gericht op de Th17-cellen van het immuunsysteem suggereert dat de vorm en functie van hun mitochondriën belangrijk is bij auto-immuunziekten en inflammatoire aandoeningen, zoals multiple sclerose. T-helper 17 (Th17)-cellen zijn een type CD4+ T-immuuncel, die samen helpen bij het maken van antilichamen, het activeren van vijand-etende cellen en het rekruteren van meer soldaten voor het strijdfront.
Het onderzoek, geleid door Erika Pearce, Ph.D., aan het Bloomberg~Kimmel Institute for Cancer Immunotherapy in het Johns Hopkins Kimmel Cancer Center, suggereert dat het leren hoe mitochondriën Th17-cellen beïnvloeden, essentieel is om te begrijpen hoe ze te beheersen.
De studie, gepubliceerd op 28 september in het tijdschrift Nature , identificeert verschillende manieren om te proberen het gedrag van deze belangrijke cellen te beïnvloeden, met als doel hun auto-immuunactiviteit te dempen.
Wanneer een T-cel voor het eerst wordt blootgesteld aan een vijand, reageert deze op signalen van de vijand en de omgeving om een van de verschillende soorten gespecialiseerde T-cellen te worden, elk gewapend met verschillende functies in de immuunrespons. Hoewel alle subtypes van T-helpercellen cruciaal zijn in de strijd van het lichaam tegen buitenlanders, kan hun onbalans ook ziekten veroorzaken, waaronder diabetes type 1, astma, allergieën en chronische ontstekingen.
"Als we T-cellen zouden kunnen beheersen, zouden we aantoonbaar veel, zo niet de meeste, infecties, auto-immuniteiten en kankers kunnen beheersen", zegt Pearce, de senior auteur van de studie en een Johns Hopkins Bloomberg Distinguished Professor in de afdeling Oncologie en de afdeling Biochemie en Moleculaire Biologie.
De studie begon toen onderzoekers in het laboratorium van Pearce, dat toen aan het Max Planck Instituut in Freiburg, Duitsland was, een eigenschap opmerkten die eigen was aan Th17-cellen. Van de drie belangrijkste T-effectorceltypen hadden alleen Th17-cellen langwerpige mitochondriën; dat wil zeggen, hun innerlijke krachtcentrales werden samengesmolten tot grotere structuren. "Dat was vreemd omdat langwerpige mitochondriën meestal worden gezien in rustende cellen en niet in geactiveerde cellen", zegt eerste auteur Francesc Baixauli, Ph.D., een voormalig postdoctoraal onderzoeker aan het Max Planck Instituut.
De onderzoekers wisten dat het OPA1-gen mitochondriale fusie reguleert, dus verwijderden ze het in Th17-cellen en ontdekten dat hun mitochondriën terugkeerden naar een meer gefragmenteerde grootte en vorm. De cellen stopten echter ook met hun hoofdtaak:het produceren van het signaalmolecuul interleukine-17 (IL-17).
Om dit resultaat in een organisme te bevestigen, verwijderden de onderzoekers het OPA1-gen bij muizen en bevorderden ze een ziekte bij deze dieren die menselijke multiple sclerose modelleert, die wordt aangedreven door hun Th17-cellen. Nadat OPA1 was verwijderd, stopten hun cellen niet alleen met het maken van IL-17, maar namen ook hun ziektesymptomen af.
Het team vroeg zich af hoe OPA1-deletie de productie van IL-17 stopte en dacht eerst dat de mitochondriën van de cellen gewoon niet genoeg energie produceerden. Ze ontdekten echter dat OPA1-verwijdering geen invloed had op de energieproductie en dat OPA1 cruciaal was voor de productie van IL-17, ongeacht of de metabole activiteit van de cellen hoog of laag was. Vervolgens ontdekten ze dat een centraal biochemisch proces in de mitochondriën was veranderd, waardoor de opbouw van een metaboliet werd veroorzaakt waarvan bekend is dat deze het DNA en het transcriptieprogramma van de cel beïnvloedt. "Dat molecuul dempte het vermogen van de cel om zijn DNA te lezen, en bijgevolg werd IL-17 niet langer geproduceerd", zegt Baixauli.
Om het verband tussen deze reacties en OPA1-deletie te identificeren, vergeleken de onderzoekers eiwitten geproduceerd door normale Th17-cellen en die zonder OPA1. In cellen die OPA1 missen, vonden ze een grote toename van de geactiveerde vorm van het eiwit LKB1, een metabolische sensor die het cellulaire metabolisme, de celdeling en de mitochondriale functie regelt. Toen ze zowel OPA1 als LKB1 uit cellen verwijderden, werd de IL-17-productie hersteld en werden de mitochondriale processen weer normaal.
"We denken dat LKB1 mitochondriale stress detecteert en de biochemische reacties van de mitochondriën op de juiste manier verandert, wat de productie van IL-17 beïnvloedt", zegt Pearce. "We hebben nu een korte lijst van moleculen waarvan bekend is dat ze dit belangrijke aspect van de Th17-functie beïnvloeden, wat het kantelpunt kan zijn tussen zijn nuttige en schadelijke rollen. Ons toekomstig onderzoek zal deze relaties blijven onderzoeken, zodat we hopelijk op een dag therapeutisch kunnen wijzigen hen." + Verder verkennen
Studie onthult hoofdrol voor vormveranderende mitochondriën in stamcelfunctie
 Team ontdekt dubbele helixstructuur in synthetisch macromolecuul
Team ontdekt dubbele helixstructuur in synthetisch macromolecuul Een nieuw ontdekte, natuurlijk cafeïnearme theeplant
Een nieuw ontdekte, natuurlijk cafeïnearme theeplant Studie onthult hoe zuurstofarm eiwit losjes bindt aan een mineraal
Studie onthult hoe zuurstofarm eiwit losjes bindt aan een mineraal Een nieuw materiaal voor de batterij van de toekomst
Een nieuw materiaal voor de batterij van de toekomst Een oplossing voor een harig probleem in de forensische wetenschap
Een oplossing voor een harig probleem in de forensische wetenschap
Hoofdlijnen
- De meest voorkomende organische moleculen in cellen
- De warmere stroomtemperaturen in het afgebrande stroomgebied van Oregon hebben niet geleid tot minder forel
- Wat gebeurt er tijdens de G1-fase?
- Sorry,
- Wat zijn de processen waarbij macromoleculen worden gevormd?
- De celstructuur van een ui
- VN-verdrag inzake biodiversiteit op volle zee heeft moeite om haven te verlaten
- Een bijtend rapport:onderzoek toont aan dat klimaatverandering een grote bedreiging vormt voor hommels
- Hoe moleculaire scharen ziekten kunnen oplossen en DNA kunnen bewerken
- Diversiteit van grote dieren speelt een belangrijke rol in koolstofcyclus

- Afnemende babyzangvogels hebben bossen nodig om droogte te overleven

- Wat gebeurt er met een Zygote na de bevruchting?

- Leuke wasberen zijn superleerlingen en waarschijnlijk criminele meesterbreinen uit de vuilnisbak

- Verschrikkelijke sneeuwman? Nee - studie koppelt DNA-monsters van vermeende Yeti's aan Aziatische beren

 Nieuw energieopslagapparaat kan elektrische voertuigen in enkele minuten opladen
Nieuw energieopslagapparaat kan elektrische voertuigen in enkele minuten opladen Memristors met een twist:quasi-vloeibare zachte materie is een voorbode van biocompatibele elektronica en flexibele robots
Memristors met een twist:quasi-vloeibare zachte materie is een voorbode van biocompatibele elektronica en flexibele robots Voor de eerste keer, onderzoekers observeren grafeenvellen die buckyballs worden (met video)
Voor de eerste keer, onderzoekers observeren grafeenvellen die buckyballs worden (met video) Onderzoekers gebruiken goudsubstraat om elektronencryomicroscopie op moeilijke eiwitten mogelijk te maken
Onderzoekers gebruiken goudsubstraat om elektronencryomicroscopie op moeilijke eiwitten mogelijk te maken Wetenschappers kijken toe hoe kunstmatige atomen samenkomen in perfecte roosters met vele toepassingen
Wetenschappers kijken toe hoe kunstmatige atomen samenkomen in perfecte roosters met vele toepassingen Op koolstof gebaseerde nanomaterialen laten veelbelovende resultaten zien tegen SARS-CoV-2 en 12 andere virussen
Op koolstof gebaseerde nanomaterialen laten veelbelovende resultaten zien tegen SARS-CoV-2 en 12 andere virussen Het Marangoni-effect kan worden gebruikt om zoet water uit de zee te halen
Het Marangoni-effect kan worden gebruikt om zoet water uit de zee te halen De zes delen van een experimenteel wetenschappelijk project
De zes delen van een experimenteel wetenschappelijk project
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

