
Wetenschap
Nanozyme-therapie voorkomt de vorming van schadelijke tandplak
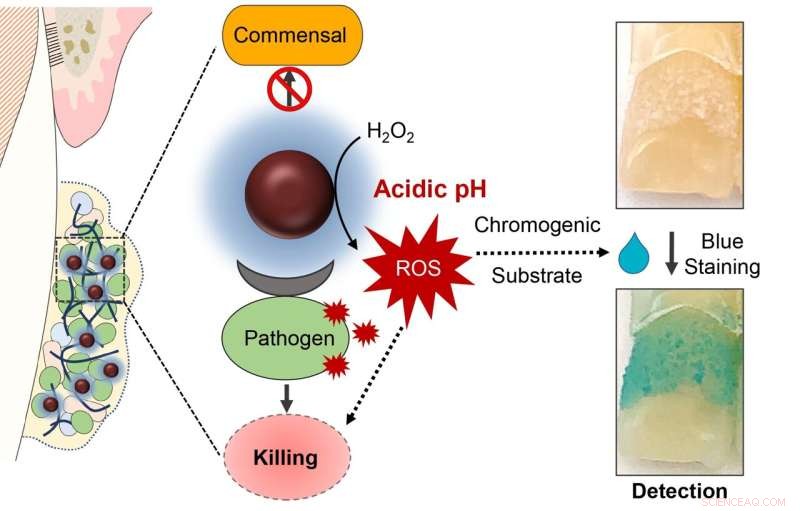
Het koppelen van ijzeroxide-nanodeeltjes met waterstofperoxide resulteert in een nauwkeurig gerichte behandeling voor het doden van schadelijke orale bacteriën, het afbreken van tandplak en zelfs het diagnosticeren van schadelijke orale biofilms, volgens een nieuwe studie. Credit:met dank aan de auteurs van het onderzoek
Een groeiend aantal bewijzen wijst op een verband tussen bloedarmoede door ijzertekort en ernstig tandbederf. Of het verband correlatief of oorzakelijk is, is onbekend, hoewel beide aandoeningen worden geassocieerd met slechte voeding en vaker voorkomen bij mensen die in verarmde omgevingen leven en met onderliggende medische aandoeningen.
Onderzoek van de Universiteit van Pennsylvania, in samenwerking met de Universiteit van Indiana, suggereert dat een door de FDA goedgekeurde therapie voor bloedarmoede door ijzertekort ook veelbelovend is voor het behandelen, voorkomen en zelfs diagnosticeren van tandbederf. Het therapeutische middel, een combinatie van een ijzeroxide-nanodeeltjesbevattende oplossing genaamd ferumoxytol en waterstofperoxide, werd aangebracht op echt tandglazuur dat in een kunstgebitachtig apparaat werd geplaatst en door de proefpersonen werd gedragen.
De studie, gepubliceerd in het tijdschrift Nano Letters , ontdekte dat een tweemaal daagse toepassing van ferumoxytol, dat waterstofperoxide activeerde in een vervolgspoeling, de opbouw van schadelijke tandplak aanzienlijk verminderde en een gericht effect had op de bacteriën die grotendeels verantwoordelijk zijn voor tandbederf. Dit soort nanodeeltjes met enzymachtige eigenschappen staan soms bekend als "nanozymen" en worden steeds vaker onderzocht vanwege hun potentieel in biomedische en milieutoepassingen.
"We ontdekten dat deze aanpak zowel nauwkeurig als effectief is", zegt Hyun (Michel) Koo, een professor aan de University of Pennsylvania School of Dental Medicine. "Het verstoort biofilms, vooral die gevormd door Streptococcus mutans , die cariës veroorzaken, en het verminderde ook de mate van glazuurverval. Dit is het eerste onderzoek waarvan we weten dat het in een klinische setting is uitgevoerd en dat de therapeutische waarde van nanozymen tegen een infectieziekte aantoont."
Het werk is een uitbreiding van een artikel uit 2018 gepubliceerd in Nature Communications , waarin Koo en collega's, waaronder David Cormode van Penn's Perelman School of Medicine, aantoonden dat de behandeling met ijzeroxide nanodeeltjes-waterstofperoxide biofilmophoping en tandbederf kan voorkomen in een experimenteel model en een diermodel.
In het huidige werk wilden de wetenschappers de volgende logische stap zetten, werken in mensen. In een gerandomiseerde studie lieten ze 15 deelnemers een verwijderbaar, kunstgebitachtig apparaat gebruiken waarop echt tandglazuur was bevestigd, een methode die is ontwikkeld en uitgebreid getest door Domenick T. Zero van de Indiana University, een co-corresponderende auteur van het huidige artikel.
De deelnemers aan het onderzoek brachten vier keer per dag een suikerhoudende oplossing op het apparaat aan, waarbij ze suikerrijke maaltijden en snacks nabootsten die in de loop van het dagelijks leven worden geconsumeerd. De deelnemers werd gevraagd de emaille exemplaren niet te poetsen, maar in plaats daarvan het apparaat twee keer per dag te spoelen. De deelnemers werden in drie groepen verdeeld, waarbij één de ferumoxytol gebruikte en vervolgens de waterstofperoxidespoeling, één met een oplossing die de inactieve ingrediënten in ferumoxytol levert, en een derde met alleen water.
Na 14 dagen analyseerden de onderzoekers de biofilms die zich op de glazuurmonsters hadden opgehoopt. Ze ontdekten dat de experimentele behandeling de groei van biofilms die S bevatten, sterk verminderde. mutans en zou deze bacterie met hoge specificiteit kunnen doden. Andere commensale bacteriën die normaal in de mond worden aangetroffen, werden niet beïnvloed door de behandeling met ferumoxytol-waterstofperoxide.
De resultaten en veiligheid van de aanpak werden ondersteund door eerder werk, dat heeft aangetoond dat de ijzeroxide-nanodeeltjes niet binden aan het slijmvliesweefsel in de mond en geen cytotoxiciteit of veranderingen in het orale microbioom veroorzaken in een diermodel.
"Deze behandeling lijkt geen schadelijke, off-target effecten te hebben", zegt Koo.
De reden voor deze precisie is drievoudig. De reactie om waterstofperoxide te katalyseren vindt alleen plaats in een zeer zure omgeving, zoals die ontstaat wanneer cariës-veroorzakende bacteriën aanwezig en actief zijn. De behandeling zorgt er ook voor dat de kleverige matrix van koolhydraten afbreekt, de biofilm afbreekt en de microben blootstelt. En ferumoxytol kan specifiek binden aan receptoren op de S. mutans celmembraan, waardoor het wordt gedood.
In een laatste fase van het onderzoek voegden de onderzoekers een marker toe die blauw wordt bij blootstelling aan reactieve zuurstofsoorten, zoals die gegenereerd door de katalyse van waterstofperoxide door ferumoxytol-nanodeeltjes. En inderdaad, het team ontdekte dat de intensiteit van blauwe labeling overeenkwam met zure biofilms die S bevatten. mutans .
Vanwege dit "detectievermogen", merkt Koo op dat de experimentele behandeling het potentieel heeft om te worden wat bekend staat als een "theranostic", dat wil zeggen een medicijn dat kan worden gebruikt om zowel een aandoening te diagnosticeren als te behandelen. "Het kan ook thuis worden gebruikt", zegt Koo. "Je zou ermee kunnen spoelen, kijken hoeveel gaatjes veroorzakende tandplak er is, en dan behandelen met de oplossing of een tandarts raadplegen voor een vervolgbehandeling." + Verder verkennen
Tandplak is geen partij voor katalytische nanodeeltjes
Hoofdlijnen
- Nieuwe studie benadrukt de effecten van een wereldwijde strategie om de antibioticaconsumptie in de productie van voedseldieren te verminderen
- Hoe Rigor Mortis te onderscheiden van een Cadaveric Spasm
- Nest van bedreigde reuzenweekschildpad gevonden in Cambodja
- De relatie tussen leeftijd en plasticiteit
- Urban Coopers-haviken overtreffen hun landelijke buren
- Wereldwijd onderzoeksteam vult taalkloof in plantenwetenschap
- De leeftijd van een skelet bepalen
- Waarom is stikstof belangrijk voor levende wezens?
- Tweekoppige slang een unieke vondst voor herpetologielab
- Onderzoekers demonstreren theoretisch de detectie van een enkele kernspin bij kamertemperatuur
- Nanocomposiet zorgt voor een perfecte opname van röntgenfoto's

- Buigbare opto-elektronische apparaten mogelijk maken:Galliumnitride-microstaafjes gekweekt op grafeensubstraten

- Nieuw wereldrecord voor fullereenvrije polymere zonnecellen

- Nieuwe nanogeneeskunde glipt door de kieren
 Onderzoek gaat naar nieuwe diepten in huidpeptide-onderzoek
Onderzoek gaat naar nieuwe diepten in huidpeptide-onderzoek De stam die een beschadigde kustlijn weer tot leven bracht
De stam die een beschadigde kustlijn weer tot leven bracht Georganiseerde chaos in het enzymcomplex - verrassende inzichten en nieuwe perspectieven
Georganiseerde chaos in het enzymcomplex - verrassende inzichten en nieuwe perspectieven UITLEG:De echte wiskunde achter netto nul koolstofemissies
UITLEG:De echte wiskunde achter netto nul koolstofemissies Restaurantbezorging wordt voor de meesten gemakkelijker, maar niet Grubhub
Restaurantbezorging wordt voor de meesten gemakkelijker, maar niet Grubhub Takken en boomtoppen kunnen de uitstoot van broeikasgassen door zwaar transport met 90% verminderen
Takken en boomtoppen kunnen de uitstoot van broeikasgassen door zwaar transport met 90% verminderen Velddiameter berekenen
Velddiameter berekenen Hoe zien de eerste steden op Mars eruit?
Hoe zien de eerste steden op Mars eruit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


