
Wetenschap
De verborgen structuur van het periodiek systeem
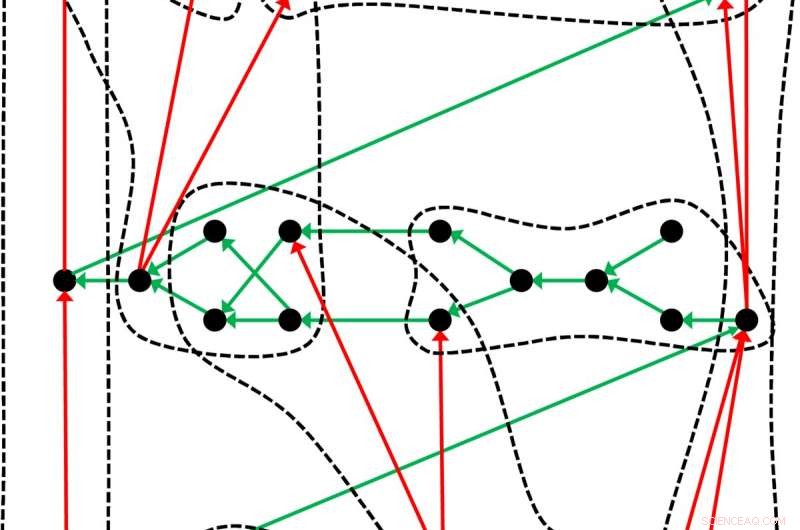
Een iets ander periodiek systeem:het systeem van chemische elementen, die teruggaat tot Dmitri Mendelejev en Lothar Meyer, is slechts één voorbeeld van hoe objecten – in dit geval de chemische elementen – in zo'n systeem kunnen worden georganiseerd. De onderzoekers uit Leipzig illustreren de algemene structuur van een periodiek systeem met dit voorbeeld:De zwarte stippen vertegenwoordigen de objecten die zijn gerangschikt door de groene pijlen. Met behulp van een geschikt criterium, de objecten kunnen worden ingedeeld in groepen (stippellijnen) waarin de rode pijlen een subvolgorde vormen. Krediet:Guillermo Restrepo, MPI voor wiskunde in de wetenschappen
Het periodiek systeem der elementen dat de meeste scheikundeboeken weergeven, is slechts één speciaal geval. Dit tabeloverzicht van de chemische elementen, die teruggaat tot Dmitri Mendelejev en Lothar Meyer en de benaderingen van andere chemici om de elementen te organiseren, omvatten verschillende vormen van representatie van een verborgen structuur van de chemische elementen. Dat concluderen onderzoekers van het Max Planck Instituut voor Wiskunde in de Wetenschappen in Leipzig en de Universiteit van Leipzig in een recent artikel. De wiskundige benadering van de Leipzigse wetenschappers is zeer algemeen en kan veel verschillende periodieke systemen opleveren, afhankelijk van het principe van orde en classificatie - niet alleen voor de scheikunde, maar ook voor vele andere kennisgebieden.
Het is een icoon van de natuurwetenschappen en hangt in de meeste scheikundelokalen:het periodiek systeem der elementen, die dit jaar zijn 150e verjaardag viert. Het tabeloverzicht is nauw verbonden met Dmitri Mendelejev en Lothar Meyer - twee onderzoekers die, in de jaren 1860, creëerde een rangschikking van elementen op basis van hun atomaire massa en overeenkomsten. Tegenwoordig zijn ze gesorteerd op atoomnummer (dat het aantal protonen in de atoomkern aangeeft) van de lichte waterstof (één proton) tot de synthetische oganesson (118 protonen). De elementen zijn ook ingedeeld in groepen:Atomen in dezelfde kolom hebben meestal hetzelfde aantal elektronen in hun buitenste schil.
Periodiek systeem in verschillende varianten
Op het eerste gezicht, het periodiek systeem lijkt een eenduidige en definitieve ordening te hebben gebracht in de nu bekende 118 elementen. Maar schijn bedriegt, want veel dingen blijven nog steeds controversieel:wetenschappers zijn het er niet over eens welke elementen precies in de derde groep onder scandium en yttrium thuishoren. Bijvoorbeeld, de juiste positie van lanthaan en actinium wordt gedebatteerd. Als men beter kijkt, men zal in klaslokalen enigszins verschillende varianten van het periodiek systeem ontdekken, collegezalen, en studieboeken.
Guillermo Restrepo en Wilmer Leal van het Max Planck Instituut voor Wiskunde in de Wetenschappen en de Universiteit van Leipzig zijn niet verrast. Voor hen, er is geen eenduidig juiste opstelling van de elementen; afhankelijk van het voor de indeling gehanteerde criterium, een ander periodiek systeem resulteert. De atomen kunnen worden onderverdeeld volgens de elektronenconfiguratie (d.w.z. het aantal en de rangschikking van hun elektronen), hun chemisch gedrag, hun oplosbaarheid, of hun voorkomen in geologische afzettingen. Het is nu algemeen aanvaard dat de chemische elementen gerangschikt moeten worden volgens hun atoomnummer en verdeeld in groepen volgens hun elektronenconfiguratie. Maar zelfs voor dit periodiek systeem, er zijn tal van verschillende vormen van vertegenwoordiging. Bijvoorbeeld:als een spiraal met verschillende uitstulpingen, piramidevormig, of als een driedimensionale bloem.
Een gemeenschappelijke structuur achter de periodieke tabellen
Guillermo Restrepo en Wilmer Leal hebben nu systematisch de dubbelzinnigheid van het periodiek systeem onderzocht. Dit heeft geleid tot bevindingen die ook buiten de chemie van groot belang zijn. Overeenkomstig, alle vormen van representatie van de chemische elementen zijn gebaseerd op een gemeenschappelijke structuur, die wiskundigen een geordende hypergraaf noemen. Het eerbiedwaardige periodiek systeem van Mendelejev en Meyer biedt dus slechts een weergave van de algemene structuur, die Guillermo Restrepo en Wilmer Leal nu postuleren. Ook hier kunnen te allen tijde nieuwe afspraken uit worden afgeleid. Guillermo Restrepo vergelijkt daarom de volgorde van de chemische elementen met een sculptuur waarop licht uit verschillende richtingen valt. "De verschillende schaduwen die de figuur werpt, zijn de periodieke tabellen. Daarom zijn er zoveel manieren om deze tabellen te maken. de periodetafels zijn projecties. Projecties van de interne structuur van het periodiek systeem."
De wetenschappers uit Leipzig proberen nu de verborgen wiskundige structuur te achterhalen waarop de bekende periodieke tabellen van de chemie zijn gebaseerd. Voorlopig, ze hebben drie voorwaarden gedefinieerd waaraan moet worden voldaan om een periodiek systeem op te stellen. Eerst, men heeft objecten nodig die besteld moeten worden. Voor Mendelejev, Meyer en de makers van de andere bekende periodieke tabellen van de chemie, dit zijn de chemische elementen. These objects must be arranged according to some properties such as the atomic mass or the atomic number (i.e. the number of protons). Eindelijk, one criterion is required to group the objects in classes. Mendeleev and Meyer used the chemical similarity for this.

A periodic table of chemical bonds:Each of the 94 circles with chemical element symbols represents the bond that the respective element forms with an organic residue. The bonds are ordered according to how strongly they are polarized. Where there is a direct arrow connection, the order is clear:Bonds of hydrogen, bijvoorbeeld, are more polarized than bonds of boron, fosfor, and palladium. The same applies to rubidium in comparison to caesium, which has particularly low polarized bonds and is therefore at the bottom of the new periodic table. If there is no direct arrow between two elements, they may still be comparable – if there is a chain of arrows between them. Bijvoorbeeld, the bonds of oxygen are more polarized than the bonds of bromine. Bonds represented by the same colour have the same binding behaviour and belong to one of the 44 classes. Credit:Guillermo Restrepo, MPI for Mathematics in the Sciences
Periodic table of chemical bonds
"If these three conditions are met, periodic tables can also be created for other chemical objects and even for objects outside chemistry, " says Guillermo Restrepo. He and Wilmer Leal show this by looking at the chemical bonds between atoms of 94 elements and different conjugates. The polarizability of 94 single-covalent bonds, where bonds are arranged according to the electronegativity and atomic radius of one of the bonded atoms. Bijvoorbeeld, fluorine, chlorine, or oxygen are highly electronegative and assume relatively small atomic radii in compounds. The bonds are then classified based on how much they resemble each other.
"We have investigated almost 5, 000 substances consisting of two elements in different proportions, " explains Guillermo Restrepo. "We then looked for similarities within this data. Bijvoorbeeld, sodium and lithium are similar because they combine with the same elements in the same proportions (e.g. with oxygen or chlorine, bromine, and iodine). We thus found patterns we can use to classify the elements."
A periodic table as a network instead of a matrix
In the 44 classes of chemical elements, there are some similarities with the main groups of Mendeleev's and Meyer's periodic table. Bijvoorbeeld, the alkali metals sodium and lithium are found in one group because they form the same simple salts with halogens such as chlorine or fluorine. Like the elements themselves, the bonds of the four halogens (fluorine, chlorine bromine, and iodine) are also found in the same group. Echter, there are also classifications that differ significantly from those in the conventional periodic table. Bijvoorbeeld, carbon and silicon are no longer in the same class because they form very different compounds.
The representation of the periodic table of chemical bonds also has nothing to do with the familiar matrix-like arrangement of the classical periodic tables of the elements. In plaats daarvan, the 94 covalent bonds are represented in a network of differently colored circles. Each circle represents a chemical bond, and the colou symbolizes belonging to one of the 44 groups. Because now two criteria are used for the sorting, there is no longer any clear order of the atoms (like in the tables of Mendeleev and Meyer)—mathematicians speak of a partial order. The circles are therefore connected to other circles by one or more arrows, thereby creating an ordered hypergraph.
Periodic tables in other scientific fields
The chemical elements and their compounds can also be represented in completely different periodic tables—depending on the underlying order and classification principle. What's more:The objects of numerous other scientific fields and their applications can also be arranged in periodic tables. Bijvoorbeeld, ordered hypergraphs are used in information systems and web mining. Possible periodic systems also emerge when countries are considered; these can be classified according to social or economic indicators as well as geographical proximity or cultural similarity. Other examples can be found in engineering, environmental sciences, sociologie, and many other disciplines. The scientists not only study periodic systems because of their importance for chemistry, maar, bovenal, because of their applications in many other disciplines.
 Hoe de markt voor ruwe olie werkt
Hoe de markt voor ruwe olie werkt  Het kooldioxidegehalte boven Australië steeg, zelfs nadat COVID-19 de wereldwijde uitstoot had doen dalen. Dit is waarom
Het kooldioxidegehalte boven Australië steeg, zelfs nadat COVID-19 de wereldwijde uitstoot had doen dalen. Dit is waarom Mestfeest en hongersnood:het wereldwijde stikstofprobleem oplossen
Mestfeest en hongersnood:het wereldwijde stikstofprobleem oplossen Een indianendorp vecht om de poep naar de wc te brengen
Een indianendorp vecht om de poep naar de wc te brengen Wil je gezond eten? Probeer een milieuvriendelijk dieet
Wil je gezond eten? Probeer een milieuvriendelijk dieet
Hoofdlijnen
- Eksters kunnen vriendschappen sluiten met mensen - dit is hoe
- Factoren die celdeling beïnvloeden
- Onderzoekers ontwikkelen krachtige nieuwe methode voor microbioomanalyse
- De oproepen van pinguïns worden beïnvloed door hun leefgebied
- Eerste luxe Perigord-truffel wordt in Groot-Brittannië verbouwd
- Wat is het ultieme eindresultaat van glycolyse?
- Biochemistry Blotting Techniques
- Mannetjes passen de snelheid van het sperma snel aan om rivalen te verslaan, studie vondsten
- Wat is celcompartimentering en waarom gebeurt het?
- Oud scheepswrak wordt toegankelijk gemaakt voor duikers in Griekenland

- Nieuw onderzoek meldt ontdekking van 5 miljoen jaar oud honingdasachtig dier

- Twitter-onderzoek volgt vroege dagen van COVID-19-pandemie in de VS

- taalkundig, WhatsApp-berichten werken als een spontaan informeel gesprek
- Newsrooms houden de veranderende demografie niet bij, studie suggereert:

 Kijk hoe asteroïde 2016 VA door de schaduw van de aarde gaat
Kijk hoe asteroïde 2016 VA door de schaduw van de aarde gaat Voor het eerst is er een Bose-Einstein-condensaat in de ruimte geproduceerd
Voor het eerst is er een Bose-Einstein-condensaat in de ruimte geproduceerd Imec rapporteert asymmetrische nanostructuren voor vroege en nauwkeurigere voorspelling van kanker
Imec rapporteert asymmetrische nanostructuren voor vroege en nauwkeurigere voorspelling van kanker NASA vindt nog een klein gebied met sterke stormen in vervagende Flossie
NASA vindt nog een klein gebied met sterke stormen in vervagende Flossie Voorgestelde test van kwantumsuperpositie meet kwantumopwekkingen
Voorgestelde test van kwantumsuperpositie meet kwantumopwekkingen Koud weer is verantwoordelijk voor bijna alle temperatuurgerelateerde sterfgevallen
Koud weer is verantwoordelijk voor bijna alle temperatuurgerelateerde sterfgevallen Kubieke vergelijkingen oplossen
Kubieke vergelijkingen oplossen Premera Blue Cross betaalt staten $ 10 miljoen voor datalek
Premera Blue Cross betaalt staten $ 10 miljoen voor datalek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

