
Wetenschap
Door een chemisch proces krijgt het peptide een structuur die lijkt op amyloïde plaques die worden aangetroffen bij neurodegeneratieve ziekten
Peptiden zijn biomoleculen die worden gevormd wanneer twee of meer aminozuren die sleutelfuncties vervullen in het menselijk organisme, zoals hormonen, neurotransmitters, pijnstillers en antibiotica, aan elkaar binden. Om deze reden worden ze bijvoorbeeld veel bestudeerd en gebruikt door de farmaceutische industrie.
Een onderzoek uitgevoerd door wetenschappers van de afdeling Biofysica van de Medische School van de Federale Universiteit van São Paulo (EPM-UNIFESP) in Brazilië heeft significante veranderingen in de fysisch-chemische eigenschappen van peptiden geïdentificeerd tijdens een spontaan proces van chemische verandering dat pyroglutaminatie wordt genoemd.
Pyroglutaminatie is een modificatie die voortvloeit uit de spontane omzetting van glutamine in pyroglutaminezuur, met een aanzienlijke impact op de fysische en chemische eigenschappen van peptiden. Het is een bekend maar vaak over het hoofd gezien onderdeel van de peptidesynthese en wordt zelden onderzocht in de proteomics.
De onderzoekers die het onderzoek hebben uitgevoerd, benadrukken dat het snel kan optreden en versnelt naarmate de temperatuur stijgt, wat de noodzaak van voorzichtigheid tijdens laboratoriumexperimenten onderstreept om glutaminecyclisatie te voorkomen. Het is vooral belangrijk in omstandigheden die fysiologische omgevingen nabootsen waar de temperatuur rond de 37° C ligt, de normale temperatuur van een gezond menselijk organisme.
De ontdekking heeft implicaties voor laboratoriumonderzoek en opent nieuwe perspectieven voor de studie van neurodegeneratieve ziekten zoals de ziekte van Alzheimer en Parkinson, omdat het molecuul na chemische modificatie een amyloïdale structuur krijgt, die de aggregatie van moleculen bevordert, waardoor plaques worden gevormd zoals die waarvan wordt aangenomen dat ze de ziekten veroorzaken. in kwestie.
Een artikel over het onderzoek is gepubliceerd in Biochemistry .
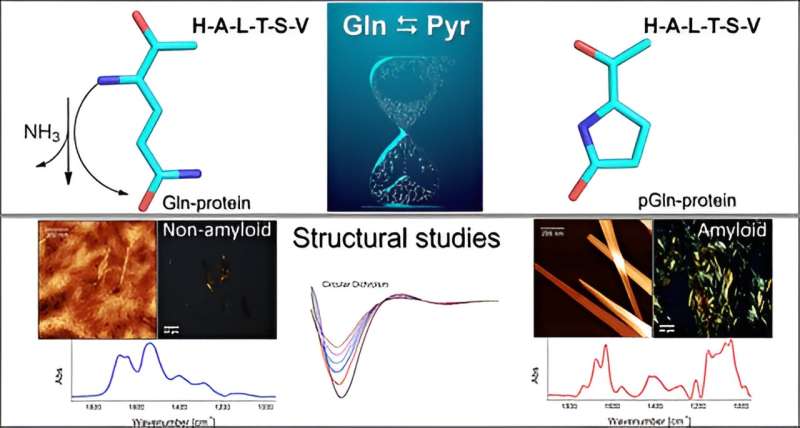
De groep voerde in vitro-experimenten uit om het mechanisme te onderzoeken waarbij het aminozuur glutamine (Gln) pyroglutaminezuur (Pyr) wordt in aanwezigheid van een peptide- of eiwitsequentie aan het N-terminale uiteinde. Dit proces vindt plaats door middel van deamidering, een reactie waarbij ammoniak (NH3) wordt geëlimineerd ). Pyr (ook wel pyroglutamaat genoemd) is een cyclisch aminozuur dat wordt gevormd als gevolg van dehydratatie van glutamaat. Alle eiwitten bestaan uit meerdere aminozuren die met elkaar zijn verbonden door peptidebindingen, met variaties in het aantal en de volgorde van aminozuren.
“Het resultaat kan als model dienen voor veel onderzoekers die met peptiden werken. We kwamen tot twee belangrijke bevindingen. We keerden terug naar een oud onderwerp, namelijk hoe glutamine afbreekt tot pyroglutaminezuur, maar we hebben een waarschuwing geïntroduceerd over het belang van het analyseren de volgorde. Het tweede punt was dat na de omzetting van het peptide de eigenschappen veranderen en dat het de neiging heeft om aan membranen te blijven plakken."
"De aanwezigheid van pyroglutaminezuur bevordert de vorming van amyloïdogene aggregaten, vergelijkbaar met de conglomeraten die doorgaans worden aangetroffen in gevallen van neurodegeneratieve ziekten. Deze amyloïde plaques worden gevormd in de hersenen en onderbreken de stroom van neuronen", zegt Clovis Ryuichi Nakaie, de laatste auteur van het boek. artikel.
Fasen van het onderzoek
De modelpeptidesequentie (QHALTSV-NH2) die in het onderzoek werd gebruikt, is afkomstig uit de Ph.D. onderzoek van Mariana Machado Leiva Ferreira, eerste auteur van het artikel, terwijl ze op zoek was naar een synthese van zo'n twintig peptiden die aanwezig zijn in de sequenties van vijf G-eiwit gekoppelde receptoren (GPCR's) die in grootte varieerden tot ongeveer 20 aminozuren. GPCR's vangen een breed scala aan extracellulaire signalen op (variërend van fotonen tot ionen, eiwitten, neurotransmitters en hormonen) en activeren signaalroutes in cellen.
Eén van de door Ferreira gesynthetiseerde peptiden viel op door zijn lage opbrengst en was de enige met glutamine aan het amine-uiteinde. "Na de eerste poging tot synthese met een zeer lage opbrengst hebben we verschillende parameters gevarieerd om de productie van het peptide te verhogen, inclusief veranderingen aan het synthetische deel en aan het zuiveringsproces, maar helaas werd het altijd gedeeltelijk afgebroken", zei ze.
Toen de groep oplossingen testte die vaak in proteomische experimenten werden gebruikt, ontdekten ze dat de omzetting van glutamine in pyroglutaminezuur in al deze oplossingen plaatsvond als een functie van de tijd, in overeenstemming met de typische eerste-orde kinetiek, waarbij de omzettingssnelheid evenredig was aan de tijd die nodig was door de reactie. Vervolgens besloten ze de oplossing niet in beroering te brengen, zodat het gesprekspercentage kon worden afgeleid. Zo schatten ze dat na vijf uur waarschijnlijk minstens 10% van de glutamine is omgezet in pyroglutaminezuur.
Een kleine structurele verandering die werd veroorzaakt toen het natieve peptide aan het N-terminale uiteinde werd gepyroglutamineerd, was voldoende om het fysisch-chemische gedrag van het molecuul te veranderen.
"Omdat het cyclisch is en één positieve lading minder heeft, zou het peptide Pyr hydrofoob moeten zijn dan het oorspronkelijke molecuul, en daarom verwachtten we dat de analoog zou interageren met membraan-mimetische systemen. Wat we niet hadden voorzien was dat de analoog de vorming van amyloïde structuren zoals die worden gezien bij neurodegeneratieve ziekten. We hebben geen van deze onderzocht, maar onze resultaten wijzen in die richting”, vertelde Emerson Rodrigo da Silva, de voorlaatste auteur van het artikel, aan Agência FAPESP. Silva en Nakaie zijn de corresponderende auteurs.
Nakaie benadrukte het belang van post-translationele veranderingen in het organisme waarbij de polypeptideketen betrokken is. Ze spelen een rol in de functionele diversiteit van eiwitten en maken aanpassing mogelijk van een reeks aminozuren gecodeerd door een gen om verschillende regulerende functies uit te voeren.
“In deze context zal tijd als factor altijd correleren met het optreden van veranderingen, ongeacht hun snelheid of locatie in ons organisme. Dit herinnert aan het idee van de biologische klok en is de reden waarom we voorstelden om een zandloper op de omslag te plaatsen. van het tijdschrift om de spontane bekering van Gln in Pyr te symboliseren,' zei Nakaie.
Hij is al 45 jaar hoogleraar bij EPM-UNIFESP en benadrukte het baanbrekende werk van de groep binnen de afdeling Biofysica. Hij merkte vooral op dat ze de synthese en biochemie van peptiden en aminozuurderivaten in Brazilië introduceerden.
"Onze bevindingen zullen ongetwijfeld de weg vrijmaken voor verder onderzoek. Na het voltooien van het werk waarvan het promotieonderzoek van Mariana Ferreira deel uitmaakte, willen we ook doorgaan met deze onderzoekslijn", zei hij.
Meer informatie: Mariana M. L. Ferreira et al, Pyroglutaminatie-geïnduceerde veranderingen in de fysisch-chemische kenmerken van een CXCR4-chemokinepeptide:kinetische en structurele analyse, Biochemie (2023). DOI:10.1021/acs.biochem.3c00124
Journaalinformatie: Biochemie
Geleverd door FAPESP
 Onderzoekers ontrafelen de actieve fase in katalytische reductie van kooldioxide tot methanol
Onderzoekers ontrafelen de actieve fase in katalytische reductie van kooldioxide tot methanol Doorbraak in synthese van scheikundigen bevordert een krachtig middel tegen kanker
Doorbraak in synthese van scheikundigen bevordert een krachtig middel tegen kanker Beschrijf de vorming van zowel positieve als negatieve ionen
Beschrijf de vorming van zowel positieve als negatieve ionen Onderzoekers ontdekken hoe eiwitpaar cellulaire calciumsignalen controleert
Onderzoekers ontdekken hoe eiwitpaar cellulaire calciumsignalen controleert Ontwerpprincipes voor peroxidase-nabootsende nanozymen
Ontwerpprincipes voor peroxidase-nabootsende nanozymen
 Milieu-impact van 57.000 bewerkte voedingsmiddelen met meerdere ingrediënten onthuld
Milieu-impact van 57.000 bewerkte voedingsmiddelen met meerdere ingrediënten onthuld Onderzoekers ontwikkelen een model om de krachten die tsunami's veroorzaken beter te begrijpen
Onderzoekers ontwikkelen een model om de krachten die tsunami's veroorzaken beter te begrijpen Alberta trekt zich terug uit CO2-belastinginitiatief na pijplijnuitspraak
Alberta trekt zich terug uit CO2-belastinginitiatief na pijplijnuitspraak Toegangspoort tot de onderwereldkrater helpt wetenschappers de klimaatgeschiedenis van de aarde in kaart te brengen
Toegangspoort tot de onderwereldkrater helpt wetenschappers de klimaatgeschiedenis van de aarde in kaart te brengen De tropen breiden zich uit, en klimaatverandering is de belangrijkste boosdoener
De tropen breiden zich uit, en klimaatverandering is de belangrijkste boosdoener
Hoofdlijnen
- Een vogel in de bush is $223 waard, 851 in de hand
- Hoe fenotypische ratio te berekenen
- Een konijn ontleden
- Nieuwe superresolutiemicroscopiebenadering visualiseert interne celstructuren en clusters via selectieve vlakactivatie
- Deze oude slang in India was misschien langer dan een schoolbus en woog een ton
- Het veredelen van zeer productieve maïs heeft zijn aanpassingsvermogen verminderd
- Hoe natuurkunde en biologie samenwerken om de mechanismen van het leven te verkennen
- Zeewier bevat veel vitamines en mineralen, maar dat is niet de enige reden waarom westerlingen er meer van zouden moeten eten
- Wat zijn Prions?
- Koolstofketens nemen fusilli- of spaghetti-vormen aan als ze oneven of even getallen hebben
- Een eenstaps multikatalytische methode om racemische mengsels te verrijken tot een enkele enantiomeer
- Draagbare elektronica voor continue cardiale, ademhalingsbewaking

- Onderzoekers ontwikkelen duurzaam katalyseproces
- Nieuwe procedure zal de behoefte aan zeldzame metalen in chemische synthese verminderen
 De wereld kijkt toe terwijl Californië een controversieel plan overweegt om tropische bossen te redden
De wereld kijkt toe terwijl Californië een controversieel plan overweegt om tropische bossen te redden Nieuwe gegevens onthullen Britse zeespiegelrecords die 200 jaar teruggaan
Nieuwe gegevens onthullen Britse zeespiegelrecords die 200 jaar teruggaan NASA ziet krachtige tropische cycloon Enawo aan land komen in Madagaskar
NASA ziet krachtige tropische cycloon Enawo aan land komen in Madagaskar Teslas Musk bespot het Amerikaanse bureau slechts enkele dagen nadat hij er genoegen mee heeft genomen
Teslas Musk bespot het Amerikaanse bureau slechts enkele dagen nadat hij er genoegen mee heeft genomen Waarom is het wenselijk dat microscoopdoelstellingen parfocaal zijn?
Waarom is het wenselijk dat microscoopdoelstellingen parfocaal zijn?  Onderzoeksteam produceert nieuwe nanosheets voor nabij-infraroodbeeldvorming
Onderzoeksteam produceert nieuwe nanosheets voor nabij-infraroodbeeldvorming Onderzoekers maken nanogestructureerde koolstof met behulp van het afvalproduct zaagsel
Onderzoekers maken nanogestructureerde koolstof met behulp van het afvalproduct zaagsel Klimaatverandering bedreigt ijsgrotten in Oostenrijk
Klimaatverandering bedreigt ijsgrotten in Oostenrijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

