Wetenschap
Hoe natuurkunde en biologie samenwerken om de mechanismen van het leven te verkennen
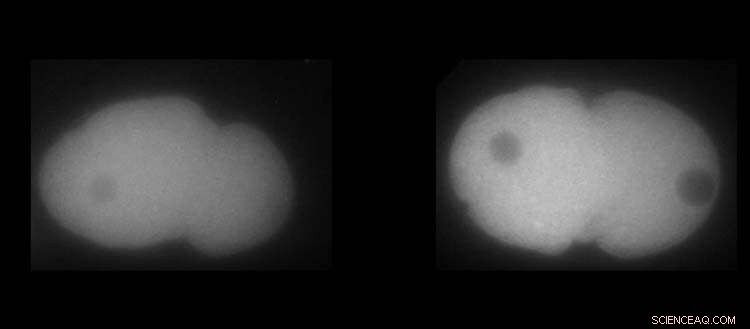
Links, MEX-5 eiwit. Juist, PLK-1-eiwit in embryo's van C. elegans. Wit toont de hogere of lagere aanwezigheid van de eiwitten. Krediet:UNIGE / Laboratoire Monica Gotta
Elk van onze cellen bevat ongeveer 40 miljoen eiwitten die samen alle taken uitvoeren die de cel nodig heeft om te overleven. Voor een vlotte werking moeten de juiste eiwitten geconcentreerd zijn in bepaalde hoeveelheden, op een bepaald tijdstip en op een specifieke locatie. Het tot stand brengen van zo'n delicate distributie vereist echter een uiterst nauwkeurig proces, dat plaatsvindt met kleine ruimtelijke resoluties die standaard celbiologietools vaak niet kunnen detecteren. Om te begrijpen hoe dit mechanisme werkt, ontwikkelden onderzoekers van de Universiteit van Genève (UNIGE) een nieuwe benadering door genetica en celbiologische experimenten te combineren met fysieke modellering. Met behulp van specifieke algoritmen simuleerden ze de vorming van eiwitgradiënten in 3D en door de tijd heen en konden ze deze complexe mechanismen verklaren. Bovendien kan hun innovatieve model worden aangepast aan andere biologiesystemen om de eiwitdynamiek te onderzoeken. Deze resultaten zijn te lezen in de Proceedings of the National Academy of Sciences .
Als een druppel inkt in een glas water, kunnen eiwitten zich door de cel verspreiden en gelijkmatig verdelen. Voor heel wat taken moeten eiwitten echter gradiënten vormen. "Eiwitgradiënten, die het gevolg zijn van de ongelijke verdeling van eiwitten in specifieke cellulaire gebieden, staan centraal in veel cellulaire en organismale functies", legt Monica Gotta uit, een professor in de afdeling Celfysiologie en Metabolisme en in het Translational Research Center in Onco- hematologie (CRTOH) aan de UNIGE Faculteit der Geneeskunde, die dit werk leidde. "Proteïnegradiënten zijn bijvoorbeeld belangrijk voor celdifferentiatie, het proces waarbij de verschillende celtypes die een complex organisme vormen voortkomen uit een unieke cel, de bevruchte eicel."
Een gebruik van willekeur
Van het PLK-1-eiwit, een belangrijke regulator van celdeling, is bekend dat het meer geconcentreerd is aan de voorste zijde van het embryo. Maar hoe kan dit mechanisme worden ingevoerd, en wat zou het gevolg zijn als het kleinste detail mis zou gaan? Omdat de gebruikelijke hulpmiddelen van de biologie niet voldoende waren om deze vraag te beantwoorden, was Monica Gotta verheugd een fysicus, Sofia Barbieri, postdoctoraal onderzoeker bij de afdeling Celfysiologie en Metabolisme van de UNIGE-faculteit Geneeskunde, in haar team te verwelkomen.
"Door al het bekende over dit biologische proces en nieuwe hypothesen over de mechanismen te verzamelen, ontwikkelde ik een statistisch model voor de vorming van eiwitgradiënten op basis van probabilistische wiskunde", legt Sofia Barbieri uit. "Ik nam mijn toevlucht tot specifieke computationele algoritmen, Monte Carlo-simulaties genaamd, genoemd naar de beroemde gokstad." Deze algoritmen worden gebruikt om fenomenen met een hoge mate van complexiteit te modelleren, zoals financiën, handel of deeltjesfysica.
Het team was in staat om eiwitgradiënten te simuleren, niet alleen in 3D, maar ook door de tijd. Een dergelijk model vereiste echter verschillende iteraties tussen parameteroptimalisatie en vergelijking met biologische gegevens. De onderzoekers bouwden een eerste versie van het model waarin alle bekende fysieke en biologische elementen van het systeem zijn verwerkt, en introduceerden vervolgens specifieke parameters die nodig waren om verschillende hypothesen over de onbekende variabelen te testen. Ze simuleerden mogelijke fysieke en biologische uitkomsten die de eiwitdynamiek en gradiëntvorming in de cel computationeel reproduceerden, en testten ze in het echte leven met in vivo experimenten met behulp van de embryo's van een kleine worm, de C. elegans-nematode.
Ingewikkelde eiwitinteracties in het spel
Dankzij de voortdurende wisselwerking tussen modellering en celbiologie konden de UNIGE-onderzoekers bepalen hoe de PLK-1-gradiënt in de loop van de tijd tot stand kwam en bleef. PLK-1 moet inderdaad dynamisch binden aan en losmaken van MEX-5, een ander eiwit dat cruciaal is voor ontwikkeling in het C. elegans-embryo, om zijn natuurlijke neiging om homogeen in de cel te diffunderen tegen te gaan. MEX-5 heeft inderdaad het vermogen om zijn diffusiviteit te veranderen afhankelijk van zijn positie in de cel en om te interageren met andere eiwitten, wat essentieel is om PLK-1 waar nodig te verrijken. "Maar verrassend genoeg is MEX-5 niet zo efficiënt in zijn taak, aangezien een grote hoeveelheid PLK-1 niet gebonden is aan MEX-5", zegt Sofia Barbieri.
Deze studie biedt een uniek kwantitatief model voor het begrijpen van dynamische interacties tussen eiwitten en kan worden aangepast aan andere cellen of eiwitten waarvoor de complexe mechanismen niet kunnen worden getest met gebruikelijke celbiologische experimenten. "Ons werk laat zien dat interdisciplinaire samenwerkingen steeds belangrijker worden om vooruit te komen in onderzoek", besluit Monica Gotta.
 Waarom is een hoge PH slecht in je lichaam?
Waarom is een hoge PH slecht in je lichaam?  Nieuw enzym breekt afval af voor goedkopere biobrandstoffen, bioproducten
Nieuw enzym breekt afval af voor goedkopere biobrandstoffen, bioproducten Een Science Fair Project op tandbederf
Een Science Fair Project op tandbederf  Wetenschappers vinden nieuwe technologie uit om de ontdekking van medicijnen te stroomlijnen
Wetenschappers vinden nieuwe technologie uit om de ontdekking van medicijnen te stroomlijnen Chemische verbindingen in voedingsmiddelen kunnen een belangrijk SARS-CoV-2-enzym remmen
Chemische verbindingen in voedingsmiddelen kunnen een belangrijk SARS-CoV-2-enzym remmen
 Hittegolf Spanje breekt records en doodt er één
Hittegolf Spanje breekt records en doodt er één Hoe de chemische industrie de klimaatdoelen kan halen
Hoe de chemische industrie de klimaatdoelen kan halen Voorgestelde bosuitdunning zal de natuurlijke klimaatadaptatie van bossen saboteren, weerstand tegen droogte, vuur, uitbraken van insecten
Voorgestelde bosuitdunning zal de natuurlijke klimaatadaptatie van bossen saboteren, weerstand tegen droogte, vuur, uitbraken van insecten Nederlandse wetgevers nemen ambitieuze wet aan om uitstoot te verminderen
Nederlandse wetgevers nemen ambitieuze wet aan om uitstoot te verminderen Wereldwijde honger naar rundvlees, soja voedt Amazonebranden
Wereldwijde honger naar rundvlees, soja voedt Amazonebranden
Hoofdlijnen
- Besmettelijk geeuwen
- Hoe zijn fotosynthese en cellulaire ademhaling gerelateerd
- Hoe evolueren genomen tussen soorten? Team onderzoekt de sleutelrol van 3D-structuur in mannelijke geslachtscellen
- Wereldwijd belang van honingbijen voor natuurlijke habitats vastgelegd in nieuw rapport
- Wat is een regeling in de microbiologie?
- Wat is het verschil tussen continue en discontinue DNA-synthese?
- Genomisch onderzoek onthult aanwijzingen voor het wilde verleden van druiven
- Wat zijn lobben in een kern?
- Onderzoekers bestuderen het suikeropnamemechanisme van industrieel micro-organisme
 De verborgen prijs van IJslandse groene energie
De verborgen prijs van IJslandse groene energie China's ruimtetest raakt probleem met capsuleafwijking
China's ruimtetest raakt probleem met capsuleafwijking Vulkaan Bali geëvacueerd buiten rode zone bang om naar huis terug te keren
Vulkaan Bali geëvacueerd buiten rode zone bang om naar huis terug te keren Kunststof van hout? Röntgenanalyse wijst de weg naar op lignine gebaseerde componenten op maat
Kunststof van hout? Röntgenanalyse wijst de weg naar op lignine gebaseerde componenten op maat Hoe te modificeren Paragraaf Modulus Pipe
Hoe te modificeren Paragraaf Modulus Pipe Bodemvocht zorgt voor jaarlijkse verandering in de opname van koolstof door land
Bodemvocht zorgt voor jaarlijkse verandering in de opname van koolstof door land Rapport identificeert opties om het risico op falen van onderzeese bouten op offshore booreilanden te verminderen
Rapport identificeert opties om het risico op falen van onderzeese bouten op offshore booreilanden te verminderen Hoe krijg je een baan in het Army Corps of Engineers
Hoe krijg je een baan in het Army Corps of Engineers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com