
Wetenschap
Onderzoekers ontwikkelen duurzaam katalyseproces
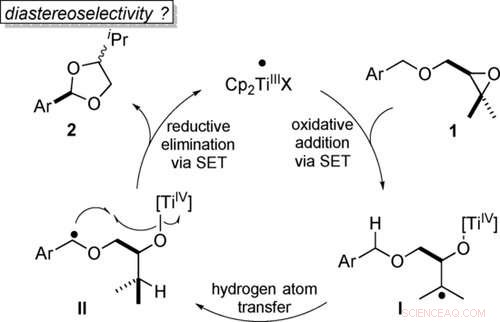
Atoom-economische transformatie van benzylethers in acetalen door titanoceen (III) katalyse in stappen met één elektron (SET). Angewandte Chemie, DOI:10.1002/anie.202013561
Acetalen zijn belangrijke chemische verbindingen die worden gebruikt, bijvoorbeeld, bij de productie van bepaalde medische middelen. Een nieuwe methode maakt hun synthese nu gemakkelijker en milieuvriendelijker. Chemici van de Universiteit van Bonn hebben het duurzame katalytische proces ontwikkeld en geoptimaliseerd. Er werd ook gebruik gemaakt van de modernste computersimulaties. De reactie is gebaseerd op een mechanisme dat vaak voorkomt in de natuur, maar is tot nu toe zelden gebruikt in chemische synthese. De resultaten worden gepubliceerd in het tijdschrift Angewandte Chemie .
De belangrijkste stap bij de productie van acetalen is de binding van twee zuurstofatomen aan één koolstofatoom. Chemici bereiken deze regeling vaak met oxidatie. Om dit te bereiken worden normaal gesproken sterke oxidatiemiddelen gebruikt door tijdens de reactie een zuurstofatoom vrij te geven. De rest van het oxidatiemiddel moet na de synthese worden weggegooid.
"In onze studie echter, beschrijven we een pad dat atomair-economisch wordt genoemd, wat betekent dat het geen afval genereert, " legt Prof. Dr. Andreas Gansäuer van het Kekulé Instituut voor Organische Chemie en Biochemie van de Universiteit van Bonn uit. "Het startmolecuul zelf bevat al het zuurstofatoom dat nodig is voor oxidatie. De katalyse die we hebben ontwikkeld, verschuift eenvoudig deze zuurstof in het molecuul, die het acetaal creëert."
Het startmolecuul bevat een zogenaamde epoxygroep, een soort "driehoek" waarin twee hoeken worden gevormd door koolstofatomen en de derde door een zuurstofatoom. Dergelijke drievoudige ringen staan onder grote spanning en breken daardoor gemakkelijk uit elkaar bij het zuurstofatoom. Epoxy's slaan de benodigde reactie-energie op als een samengedrukte veer.
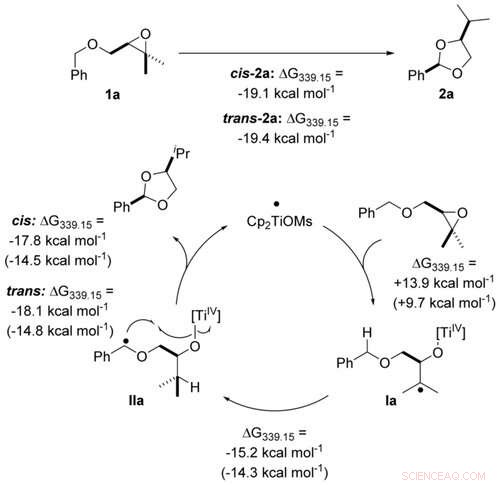
Atoom-economische transformatie van benzylethers in acetalen door titanoceen(III)-katalyse in enkele elektronstappen berekend op PW6B95‐D4/def2‐QZVP + COSMO‐RS(THF)// PBEh‐3c/DCOSMO‐RS(THF)-niveau. Waarden tussen haakjes worden berekend voor de katalysator Cp2TiCl. Angewandte Chemie, DOI:10.1002/anie.202013561
Katalyse gebaseerd op het model van de natuur
Om dit doel te bereiken is een geschikte katalysator nodig. Figuurlijk spreken, zuurstofatomen hebben twee "armen" waarmee ze bindingen kunnen vormen. Als de epoxyring breekt, een van deze armen wordt vrij. De katalysator bindt er nu tijdelijk aan. Dit initieert een reeks molecuul-interne (intramoleculaire) herschikkingen. Aan het einde van deze reeks, het zuurstofatoom geeft de katalysator weer vrij en bindt in plaats daarvan aan de gewenste koolstof. "Deze stap wordt zuurstofrebound genoemd, ", zegt Gansäuer.
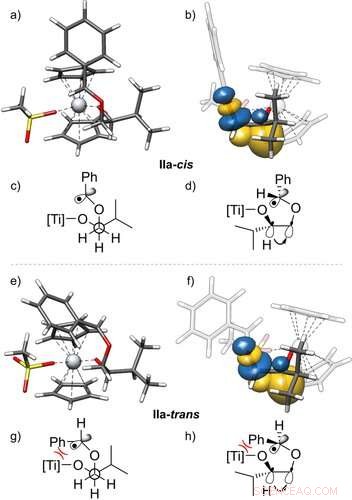
3D-structuren van de radicalen IIa‐cis (a, b) en IIa‐trans (e, f) en hun stabilisatie door gauche-interacties, met zijaanzicht. De getoonde natuurlijke bindingsorbitalen (NBO)23 zijn verkregen uit een PBEh‐3c+CPCM(THF)-berekening. Daarnaast Newman-projecties (c, g) en wig- en streepjesstructuren (d, h) van deze radicalen worden gegeven. Ze tonen de C−H-bindingsorbitaal die doneert in de σ*‐-orbitaal van de C−O-binding, het gauche-effect zichtbaar maken. Slechts een van de twee effectieve gauche-interacties wordt getoond. Isooppervlaktewaarde =0,05 e−1/2 bohr−3/2. Angewandte Chemie, DOI:10.1002/anie.202013561
Dit mechanisme is tot nu toe zelden gebruikt in chemische syntheses - heel anders dan in de natuur:de lever, bijvoorbeeld, gebruikt de "zuurstofrebound" om gifstoffen af te breken. Dit vereist ook katalysatoren, de zogenaamde P450-enzymen. Hun actieve centrum bevat een ijzeratoom. "Het hart van onze katalysator bestaat ook uit een gewoon en niet-toxisch metaal, namelijk titaan, " legt Prof. Dr. Stefan Grimme van het Instituut voor Fysische en Theoretische Chemie van de Universiteit van Bonn uit.
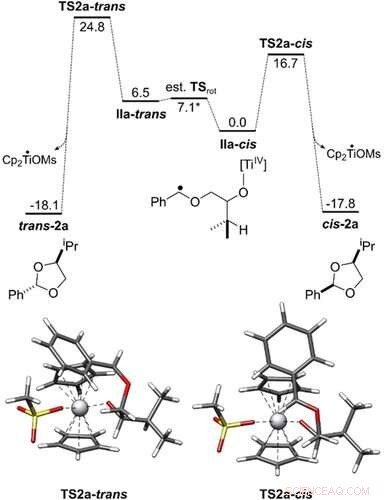
Energieprofiel van de omzetting van IIa‐cis en IIa‐trans naar cis‐2 a en trans‐2 a. Alle vrije energieën van Gibbs worden weergegeven in kcal mol−1. De geometrieën van de overgangstoestand werden verkregen met PBEh‐3c/COSMO(THF). De katalytische cyclus is onderzocht op het theoretische niveau PW6B95‐D4/def2‐QZVP + COSMO‐RS(THF)// PBEh‐3c/ COSMO(THF). Angewandte Chemie, DOI:10.1002/anie.202013561
Katalysator afstemmen op de computer
Tijdens acetaalsynthese, titanium neemt eerst een zuurstofatoom op en geeft het dan weer af (oxidatie wordt gevolgd door een zogenaamde reductie). Dit werkt alleen effectief als het de zuurstof sterk genoeg aan zichzelf bindt zonder al te veel te "kleven". Om de zuurstofaffiniteit op de juiste manier aan te passen, titanium is gebonden aan bepaalde moleculen, zijn liganden. Afhankelijk van de bindende partner, het metaal heeft dan een wat sterkere oxiderende werking of kan gemakkelijker worden gereduceerd. De meest geschikte "tuning moleculen" worden tegenwoordig met behulp van een computer geselecteerd. De onderzoeksgroep rond Prof. Grimme is gespecialiseerd in deze taak:het heeft algoritmen ontwikkeld die zeer snelle simulaties van katalysatoreigenschappen mogelijk maken.
Hierdoor konden de onderzoekers in hun studie hun katalysator optimaliseren zodat deze het uitgangsmateriaal volledig omzet in het gewenste acetaal. "Het resultaat documenteert heel mooi hoe nuttig nauwe samenwerking tussen experiment en theorie is voor het ontwikkelen van duurzame katalysemethoden, ", zegt Gansäuer.
 Waarom zit er een klein gaatje in een waterpomp?
Waarom zit er een klein gaatje in een waterpomp?  Elk moment van ultrasnelle chemische binding vastgelegd op film
Elk moment van ultrasnelle chemische binding vastgelegd op film Marangoni-stromen stimuleren de uitlijning van met fibrillaire cellen beladen hydrogels
Marangoni-stromen stimuleren de uitlijning van met fibrillaire cellen beladen hydrogels Uitdagingen bij de ontwikkeling van elektrokatalysatoren
Uitdagingen bij de ontwikkeling van elektrokatalysatoren Hoe gladde oppervlakken kleverige pasta's en gels laten glijden
Hoe gladde oppervlakken kleverige pasta's en gels laten glijden
Hoofdlijnen
- Hoe succesvol te zijn in Microbiology
- Hoe kolonies in de microbiologie te tellen
- Verander je geliefde in een boom met Bios Urn
- Wat zijn de zes menselijke zintuigen?
- Uniek veldonderzoek levert eerste overzichtsfoto van diepzeevoedselwebben op
- Aard-lucht warmtewisselaar beste manier om landbouwhuisdieren in stallen te beschermen tegen de gevolgen van klimaatverandering
- DNA-modellen van paperclips maken
- Het belang van DNA in de menselijke cel
- Hoeveel steenarenden zijn er?
- Duurzaam bouwen met milieuvriendelijk beton

- Nieuwe protonenstarter voor optogenetica

- Het verwijderen van giftig kwik uit verontreinigd water

- Nieuwe katalysatoren maken van unieke metaallegeringen
- Het terugwinnen van fosfor uit de productie van maïs-ethanol kan de grondwatervervuiling helpen verminderen

 Creatie zonder contact in de botsingen van lood- en goudkernen
Creatie zonder contact in de botsingen van lood- en goudkernen Banden die binden, en kan worden losgemaakt
Banden die binden, en kan worden losgemaakt Het kooldioxidegehalte is voor het tweede jaar op rij in recordtempo gestegen
Het kooldioxidegehalte is voor het tweede jaar op rij in recordtempo gestegen Boeing maakt 96 vluchten om software te testen op onrustige Max-jet
Boeing maakt 96 vluchten om software te testen op onrustige Max-jet Facebook om inspanningen aan te pakken om de Amerikaanse volkstelling van 2020 te verstoren
Facebook om inspanningen aan te pakken om de Amerikaanse volkstelling van 2020 te verstoren ViacomCBS benoemt NBC-exec tot hoofd CBS
ViacomCBS benoemt NBC-exec tot hoofd CBS Hubble tuurt in een stoffige nevel van sterrenstelsels
Hubble tuurt in een stoffige nevel van sterrenstelsels Samenwerking cultiveren door verwantschap
Samenwerking cultiveren door verwantschap
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

