Wetenschap
Onderzoekers ontdekken hoe eiwitpaar cellulaire calciumsignalen controleert
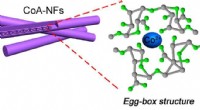
Afbeelding van de eiwitchemicus van het calciumgevoelige gebied in twee gemanipuleerde STIM1-eiwitvarianten. De sites die werden gewijzigd, zijn telkens gemarkeerd als rode bollen. Het gedrag van deze twee gemanipuleerde eiwitten gaf belangrijke inzichten in hoe STIM1 veranderingen in calciumniveaus detecteert Credit:Dr. Patrick Hogan, La Jolla Instituut voor Immunologie
Alle zoogdiercellen hebben een directe toevoer van calciumionen nodig om functies uit te voeren die zo divers zijn als neurotransmissie, spiercontractie, hormoonafgifte, of immuunreacties. Deze vereiste is zo fundamenteel dat cellen zichzelf beschermen tegen rampen door calcium op te slaan in een netwerk van intracellulaire reservoirs, het endoplasmatisch reticulum genaamd. of EHBO. Vervolgens, omdat cellen calcium verliezen als onderdeel van hun dagelijkse routine, kanalen openen zich in het celmembraan waardoor calcium van buitenaf wordt toegevoerd om de ER-reserves opnieuw te vullen en door calcium aangedreven cellulaire functies te behouden.
Twee studies die onlangs zijn gepubliceerd door Patrick Hogan, onderzoekers van het La Jolla Institute for Immunology (LJI), doctoraat, en Aparna Gudlur, Ph.D.-een paper dat begin dit jaar verschijnt in Mobiele rapporten en de andere op 31 oktober, 2018, probleem van Natuurcommunicatie - rapporteer hoe een calciumgevoelig eiwit, STIM1 genaamd, aangeeft dat het tijd is om calcium terug te halen en dat bericht vervolgens doorgeeft aan zijn partner, het calciumkanaal ORAI. Dit oeuvre legt de basis voor nieuwe manieren om afwijkende calciumsignalering in het immuunsysteem te manipuleren, vooral in de context van auto-immuun- of ontstekingsziekte.
"We weten al tien jaar dat STIM1-eiwit naar het plasmamembraan is bewogen om ORAI-kanalen te openen wanneer de ER-calciumspiegels dalen, " zegt Hogan, een professor in de afdeling signalering en genexpressie. "Ons recente werk laat zien hoe de STIM-machinerie functioneert op moleculair niveau. Het begrijpen van deze mechanismen is van cruciaal belang, omdat calcium belangrijk is voor een scala aan immuunreacties."
De Mobiele rapporten paper onthult hoe STIM1-eiwit langer wordt als het overschakelt van een rusttoestand naar een geactiveerde toestand wanneer de calciumreserves afnemen. STIM1 is een transmembraaneiwit dat de ER-wand overspant:het ene uiteinde steekt een calciumgevoelige peilstokachtige staart in het reservaat; in een rust, calciumrijke staat, de andere arm steekt uit de ER maar blijft opgetrokken tegen de ER-muur, buiten contact met slapende ORA1-kanalen die op het celmembraan stippelen.
De groep definieerde wat er gebeurt als het calciumgehalte daalt door het gedrag van genetisch gemodificeerde STIM1-eiwitten in gekweekte cellen te construeren en te testen. Analyse toonde aan dat calciumverlies van de sensorstaart ervoor zorgde dat de membraanoverspannende gebieden van paren STIM1-eiwitten samentrokken in de ER-wand, waardoor de buitenste armen zich naar het celmembraan uitstrekken. Die vormverandering bracht STIM1 dicht genoeg bij ORAI-kanalen om uit te reiken en ze te openen, waardoor calcium terug in de cellen kan stromen.
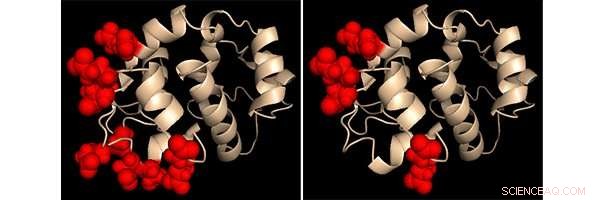
Microscoopbeelden van het regulerende eiwit STIM1--- genetisch gelabeld met een groene fluorescerende tag-- in dezelfde cel vóór stimulatie (linker paneel) en na stimulatie (rechter paneel). STIM1 herlokaliseert, wanneer de cel wordt gestimuleerd, naar plaatsen waar het het calciumkanaal ORAI1 kan poorten. Het mechanisme dat deze STIM1-beweging in gang zet, was de focus van de twee onderzoeken. Krediet:Dr. Aparna Gudlur, La Jolla Instituut voor Immunologie
"Het eerste artikel liet zien hoe STIM1 via een structurele verandering communiceert met een kanaaleiwit in het plasmamembraan, " zegt Hogan. "Ons nieuwste artikel neemt dat proces een stap terug in de tijd en onthult hoe calciumverlies in de ER die verandering initieert."
Simpel gezegd, het meer recente artikel richt zich op de werking van STIM1's calcium-detecterende peilstok. Eerder, eiwitchemici ontdekten dat calcium in het ER zich bindt aan een structureel motief in de STIM1-staart, een "EF-hand" genaamd, en stelden voor dat wanneer de hand leeg was, STIM1 geactiveerde ORAI. Gudlur, een instructeur in het Hogan-lab en de eerste auteur van het nieuwe artikel, legt uit dat het niet zo eenvoudig is. "We melden nu dat meerdere calciumsoorten niet alleen binden aan de EF-hand, maar ook aan andere plaatsen in het STIM1 ER-domein, en dat de sites van elkaar afhankelijk zijn, " zegt ze. "Dat herziet het concept van hoe STIM1 wordt geactiveerd."
Niet alleen dat, maar volgens Hogan was de heersende overtuiging dat calciumdissociatie ervoor zorgt dat het peilstokachtige gebied van STIM1 in het ER zich dramatisch ontvouwt en een chaotische structuur aanneemt, een wanorde die noodzakelijk wordt geacht voor ORAI-activering. "We laten nu zien dat wanneer calcium laag is in het ER, deze regio zich niet ontvouwt, maar in plaats daarvan een nieuwe maar stabiele structuur krijgt die de interactie met het ORAI-kanaal bevordert, " zegt hij. "Dat is belangrijk omdat het betekent dat de interactie door remmers zou kunnen worden gericht."
In feite, farmaceutische bedrijven hebben al geprobeerd medicijnen te ontwikkelen om ORAI-calciumkanalen te blokkeren als middel om calciumafhankelijke immuunresponsen bij auto-immuunziekten of bij ontstekingsaandoeningen zoals acute pancreatitis te stoppen. Sommige ORAI-blokkerende geneesmiddelen bevinden zich momenteel in fase I en II klinische onderzoeken en lijken tot dusver niet-toxisch. Maar hun therapeutisch potentieel blijft onbekend.
Gudlur, die een leidende rol had in beide studies, speculeert dat het ontwikkelen van directe ORAI/STIM1-blokkers als therapie slechts een eerste stap kan zijn, omdat beide eiwitten veel celtypen gemeen hebben. "Het richten van ORAI-kanalen als een manier om overtollige calciumsignalering alleen in bepaalde cellen te blokkeren, kan een grotere specificiteit vereisen, " zegt ze. "Ons werk is een eerste stap in het identificeren van celspecifieke factoren die ORAI/STIM1-activiteit kunnen moduleren. Zodra we ze hebben gevonden, drugscreens die op die factoren zijn gericht, zouden nodig zijn."
Hogan is het ermee eens dat het ontdekken van medicijnen is gebaseerd op verkenning. "Mensen die fundamenteel onderzoek doen, moeten fundamentele cellulaire processen onderzoeken, " hij zegt, opmerkend dat er meer dan 20 jaar verstreken tussen de ontdekking van het immuuncheckpoint-eiwit CTLA4 en de FDA-goedkeuring van immuuncheckpointblokkade als behandeling voor melanoom. (Opmerking:vier dagen na dit interview kregen de door Hogan genoemde "ontdekkers" de Nobelprijs voor Fysiologie en Geneeskunde 2018). "Als je niet aan de basis van een cel sleutelt, kom je nooit vooruit. We weten niet altijd waar therapieën vandaan komen."
 Een koolstofvrije wereld katalyseren door energie uit levende cellen te halen
Een koolstofvrije wereld katalyseren door energie uit levende cellen te halen Nieuwe klasse zachte halfgeleiders kan HD-schermen transformeren
Nieuwe klasse zachte halfgeleiders kan HD-schermen transformeren Zachte dubbele gyroids zijn uniek, maar onvolmaakt, Kristallen
Zachte dubbele gyroids zijn uniek, maar onvolmaakt, Kristallen Wetenschappers stellen een nieuwe strategie voor om het celcommunicatienetwerk te reguleren
Wetenschappers stellen een nieuwe strategie voor om het celcommunicatienetwerk te reguleren Een elektrokatalysator voor de reactie van zuurstofontwikkeling bij het splitsen van water
Een elektrokatalysator voor de reactie van zuurstofontwikkeling bij het splitsen van water
 Nieuwe analyse onthult wereldwijde verspreiding van giftige vervuiling en klimaatverandering
Nieuwe analyse onthult wereldwijde verspreiding van giftige vervuiling en klimaatverandering Hoe te identificeren Utah Knaagdieren
Hoe te identificeren Utah Knaagdieren  Hoe coronavirus een slecht natuurbrandseizoen nog erger kan maken
Hoe coronavirus een slecht natuurbrandseizoen nog erger kan maken Grote overstromingen in Manilla terwijl tyfoon Filipijnen teistert
Grote overstromingen in Manilla terwijl tyfoon Filipijnen teistert Kleine bomen hebben een grote impact in de strijd tegen klimaatverandering
Kleine bomen hebben een grote impact in de strijd tegen klimaatverandering
Hoofdlijnen
- Klimaatverandering kan bamboe-lemuren langzaam uithongeren
- Onderzoeker rapporteert belangrijke componenten van antivirale verdediging van honingbijen
- Wat is zelfrespect?
- Kan gentherapie kaalheid genezen?
- De reden voor het kleuren van een exemplaar op de microscoop
- Wat is een Zygote?
- Commensalisme:ik profiteer,
- De nanoscopische structuur die onze genen opsluit
- Welke mechanismen zorgen voor de nauwkeurigheid van DNA-replicatie?
 Fondsenstrijd om controle Telecom Italia krijgt nieuwe steun
Fondsenstrijd om controle Telecom Italia krijgt nieuwe steun Misvattingen over klimaatverandering die veel voorkomen bij leraren, studie vondsten
Misvattingen over klimaatverandering die veel voorkomen bij leraren, studie vondsten Vergeet speld in een hooiberg. Probeer een invasieve soort in een meer te vinden.
Vergeet speld in een hooiberg. Probeer een invasieve soort in een meer te vinden. Wetenschappers ontwikkelen een concept van een hybride thoriumreactor
Wetenschappers ontwikkelen een concept van een hybride thoriumreactor Top 5 meest populaire wapens - en waarom
Top 5 meest populaire wapens - en waarom  Betere kleuren gebruiken in de wetenschap
Betere kleuren gebruiken in de wetenschap Waar is de meeste van de massa van een atoom gelegen?
Waar is de meeste van de massa van een atoom gelegen?  Wetenschappers bouwen leger van metaal-organische nanobloemen om kanker te behandelen
Wetenschappers bouwen leger van metaal-organische nanobloemen om kanker te behandelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com