
Wetenschap
Nieuwe eiwitstructuren om rationeel medicijnontwerp te ondersteunen
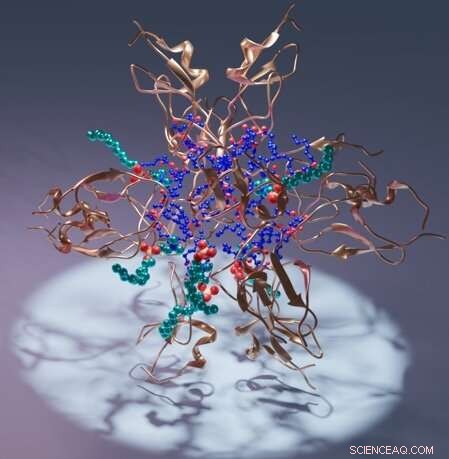
Artistieke weergave van een proteïnekinase C C1-domein (koper), het ligand diacylglycerol (blauw) en detergens (cyaan). Krediet:Sachin Katti.
Als een grote vooruitgang voor rationeel medicijnontwerp heeft een Texas A&M AgriLife-team verschillende eiwitstructuren beschreven van een cruciale speler in cellulaire processen. De vooruitgang zou nieuwe ideeën kunnen opleveren voor behandelingen van ziekten zoals Alzheimer, AIDS, kanker en andere.
In het bijzonder beschrijft het werk het C1-domein van proteïnekinase C, PKC, dat helpt bij het reguleren van de activiteit van het eiwit in organismen. In de structuren wikkelt het C1-domein zich rond verschillende moleculen van intens therapeutisch belang, wat de eerste betrouwbare gids voor atomaire resolutie biedt voor het ontwerpen van kandidaat-geneesmiddelen.
Gepubliceerd op 16 mei in Nature Communications , werd het onderzoek geleid door Tatyana Igumenova, Ph.D., universitair hoofddocent bij de afdeling Biochemie en Biofysica van het Texas A&M College of Agriculture and Life Sciences. De hoofdauteur van het project is Sachin Katti, Ph.D., een postdoctoraal onderzoeker die samenwerkt met Igumenova.
De studie omvatte een samenwerking met Inna Krieger, Ph.D., onderzoeksassistent-professor, en James Sacchettini, Ph.D., professor, beide in de afdeling Biochemie en Biofysica.
Een van de meest gewilde eiwitstructuren
Een gezonde cel reageert op precieze, ingewikkelde manieren op chemische signalen. Het ontvangen van chemische inputs van de celomgeving en het doorsturen ervan naar de centrale controlesystemen in de celkern is de taak van gespecialiseerde eiwitten zoals PKC.
Onjuiste PKC-activiteit komt voor bij veel menselijke ziekten. Als gevolg hiervan is er veel belangstelling voor het vinden van manieren om de PKC-activiteit met medicijnen te verfijnen. Het ontwerp van dergelijke medicijnen zal nieuwe benaderingen bieden voor de behandeling van de ziekte van Alzheimer, aids, kanker en meer.
"Eiwitkinase C is een van de meest intensief bestudeerde eiwitten in celbiologie en farmacologie," zei Igumenova. "Een grote hindernis was het gebrek aan precieze structurele informatie om de inspanningen voor het ontwerpen van geneesmiddelen te begeleiden."
Een complicatie bij het ontwerpen van medicijnen is dat de PKC-familie 11 leden heeft. Verschillende PKC-familieleden kunnen tegengestelde fysiologische effecten hebben, dus een succesvol kandidaat-geneesmiddel moet selectief zijn over op welke PKC het gericht is.
Om dat te doen, moeten kandidaat-geneesmiddelen op een doel-PKC passen als een sleutel tot een slot. Maar het bepalen van de 3D-structuur van een PKC "on-switch" - het C1-domein - gebonden aan PKC-activators was niet eenvoudig.
Eiwitstructuren worden meestal opgelost met behulp van röntgenkristallografie. De techniek omvat het gebruik van röntgenstralen om de positie van atomen in een kristal te bepalen. Voor deze methode moeten onderzoekers omstandigheden creëren waarin het eiwit van belang kristalliseert. Maar intense inspanningen in veel onderzoekslaboratoria in de afgelopen drie decennia hebben niet geleid tot kristallen van C1-domeinen gebonden aan relevante liganden. Vanwege dit gebrek aan vooruitgang verklaarden meerdere onderzoekers de taak onmogelijk, zei Igumenova.

Kristallen van een domein van proteïnekinase C werden spontaan gevormd in Katti's NMR-monsterbuis. Krediet:Sachin Katti.
Een probleem van 30 jaar oplossen
Katti en Igumenova accepteerden het probleem als een uitdaging en besloten in plaats daarvan de moleculen in oplossing te bestuderen met behulp van nucleaire magnetische resonantie, NMR, spectroscopie. Dit betrof het vinden van de juiste componenten om celmembranen na te bootsen, waar het C1-domein liganden zou tegenkomen.
"Toen ontdekte Sachin op een mooie dag kristallen in een oude NMR-buis," zei Igumenova. "Ik geef alle eer aan Sachin, die in feite zei:'Ik ga ze testen en kijken of ze echt het eiwit zijn.' En hij had gelijk. Het gaf ons het vertrouwen dat kristallisatie mogelijk is."
Op haar beurt hecht Katti geloof aan de inzichten verkregen uit NMR, en een beetje geluk.
"Ik denk dat dat het mooie is van onderzoek doen waarbij je meerdere benaderingen moet gebruiken," zei hij. "Je weet nooit wanneer de ene benadering nuttig zal zijn om iets met andere benaderingen te doen."
Inzichten uit NMR en röntgenkristallografie
De nieuwe eiwitstructuren, samen met de NMR-resultaten van het team, hebben al interessante informatie opgeleverd. Een al lang bestaand mysterie is hoe C1-domeinen liganden kunnen herbergen met heel verschillende chemische structuren, zei Igumenova.
"Ons eerdere NMR-werk gaf aan dat de lussen van het C1-domein die liganden binden, zeer dynamisch zijn," zei Igumenova. "Dit C1-domein is als een PAC-man. Het bindt het membraan en zoekt vervolgens naar een ligand. Zodra het het ligand heeft gevonden, klikt het vast."
Bovendien laat de structuur zien dat de ligandbindende groef aan de onderkant een "waterminnend" of hydrofiel oppervlak heeft en aan de bovenkant een "waterafstotend" of hydrofoob oppervlak.
"Als je denkt aan een lipidemolecuul, is de kopgroep hydrofiel en de staart hydrofoob," zei Igumenova. "Dus, wanneer C1-domeinen lipideliganden binden, komen de patronen overeen."
De resultaten van het team omvatten de structuur van een C1-domein gebonden aan zijn natuurlijke ligand, diacylglycerol. Daarnaast beschrijft het team verschillende andere structuren van C1 die verschillende verbindingen van farmacologisch belang bevatten.
Het werk biedt ook een methode voor het testen van verschillende kandidaat-geneesmiddelen, zei Katti.
"Als je vissen wilt bestuderen, wil je ze in water bestuderen," zei Katti. "Nu weten we hoe we een membraanachtige omgeving kunnen creëren waar deze zeer hydrofobe verbindingen kunnen worden getest op C1-binding."
Vervolgens zijn Katti en Igumenova van plan om C1-domeinen van andere PKC-familieleden te verkennen.
"Het is belangrijk voor ons om ons te concentreren op C1-domeinen omdat ze inherente verschillen hebben die kunnen worden uitgebuit om selectiviteit te bereiken," zei Igumenova. "Wat we nu ontdekken, is dat niet alle C1-domeinen gelijk zijn gemaakt." + Verder verkennen
Bevindingen onthullen nieuw activeringsmechanisme voor ALK
 Aldi rekent symbolische cent voor productiezakken in Duitsland
Aldi rekent symbolische cent voor productiezakken in Duitsland Voorspeller zegt dat bezuinigingen orkaanvoorspellingen kunnen schaden
Voorspeller zegt dat bezuinigingen orkaanvoorspellingen kunnen schaden Stofstormen en dalkoorts in het Amerikaanse Westen
Stofstormen en dalkoorts in het Amerikaanse Westen Oude klimaatverandering veroorzaakte opwarming die duizenden jaren duurde
Oude klimaatverandering veroorzaakte opwarming die duizenden jaren duurde Nieuwe studie toont impact van grootschalige boomsterfte op koolstofopslag
Nieuwe studie toont impact van grootschalige boomsterfte op koolstofopslag
Hoofdlijnen
- Hoe verschilt Cytokinese bij planten en dieren?
- Mysterieuze nieuwe zeebodemsoorten werpen licht op vroege evolutie van dieren
- Gaan roodharigen uitsterven?
- Is er een verband tussen beweging en geluk?
- Waarom lijken haaienbeten dodelijker in Australië dan elders?
- De droge gebieden van Californië zijn hotspots van plantendiversiteit
- Plant- en diercelactiviteiten voor vierde graad
- Onderzoek toont belang aan van dieren in het wild bij het bestrijden van teken
- Bultrugwalvissen verspreidden zich van pod tot pod over de Stille Oceaan
- Elektrische waterpijpen zijn misschien niet veiliger dan traditionele op houtskool gebaseerde waterpijpen

- Een tool gebaseerd op het gebruik van koolstofnanodeeltjes maakt detectie van antidepressiva in urinemonsters mogelijk

- Het volgen van pileups op de oplaadroute van de batterij om de prestaties te verbeteren

- Klik... Resistente bacteriën op heterdaad betrapt
- Biochemici ontrafelen mysteries van cellulaire vorm, functie

 Plastic tassen kunnen milieuvriendelijker zijn dan papieren en katoenen tassen in steden als Singapore
Plastic tassen kunnen milieuvriendelijker zijn dan papieren en katoenen tassen in steden als Singapore Een nieuwe aanpak om wapengerelateerd geweld op scholen in Californië te voorkomen
Een nieuwe aanpak om wapengerelateerd geweld op scholen in Californië te voorkomen Niet genoeg hazelnoten? Ons toekomstige klimaat wijst naar Australië voor nieuwe teelt
Niet genoeg hazelnoten? Ons toekomstige klimaat wijst naar Australië voor nieuwe teelt Waarom sommige ouderen digitale technologieën afwijzen
Waarom sommige ouderen digitale technologieën afwijzen Onderzoekers onderzoeken fossiel van baby-tyrannosaurus opgegraven in Montana
Onderzoekers onderzoeken fossiel van baby-tyrannosaurus opgegraven in Montana Magneten zijn chaotisch - en snel - op de allerkleinste schaal
Magneten zijn chaotisch - en snel - op de allerkleinste schaal Bevriezen in record dieptepunten? Je twijfelt misschien aan de opwarming van de aarde, zegt wetenschapper
Bevriezen in record dieptepunten? Je twijfelt misschien aan de opwarming van de aarde, zegt wetenschapper Een stellair systeem met drie superaarde
Een stellair systeem met drie superaarde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

