Wetenschap
Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen
Krediet:Wiley
Sommige bruikbare geneesmiddelen bestaan uit peptiden die inwerken op hun eiwitdoelen. Om ze efficiënter en stabieler te maken, wetenschappers hebben een manier gevonden om cruciale segmenten van de peptiden te vervangen door ureido-eenheden. Deze oligourea, die zijn samengesteld uit op ureum gebaseerde eenheden, vouwen in een structuur die lijkt op die van peptiden. Op oligoureum gebaseerde "nep"-peptiden verbeteren de opties voor rationeel medicijnontwerp, concludeert de studie gepubliceerd in het tijdschrift Angewandte Chemie .
Verschillende geneesmiddelen zijn peptiden die de werking van bepaalde eiwitten remmen of activeren. Om hun efficiëntie te verbeteren, wetenschappers onderzoeken peptide-nabootsingen. Peptide-nabootsers bevatten strengen van kleine organische eenheden die lijken op aminozuren - de bouwstenen van peptiden - maar er niet identiek aan zijn. De grondgedachte is dat proteolytische enzymen minder waarschijnlijk dergelijke valse peptidestrengen zullen aanvallen, dus de medicijnen zouden effectiever zijn.
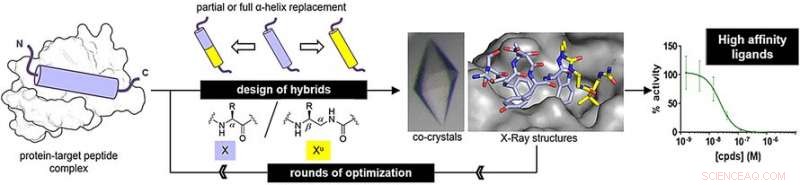
Echter, de synthetische strengen - oligomeren genoemd - moeten zich in de structuur van het oorspronkelijke peptide vouwen om op de juiste manier aan het doeleiwit te binden. Gilles Guichard en zijn team van CNRS, Universiteit van Bordeaux, en collega's van de Universiteit van Straatsburg en Ureka Pharma, Mulhouse, Frankrijk, hebben oligomeren onderzocht die zijn gemaakt van ureido-eenheden, die derivaten zijn van ureum. Deze oligourea vouwen in een helix, een van de kenmerkende structuren van peptiden. Echter, er zijn kleine verschillen. "Oligourea-helices hebben minder residuen per beurt, een kleinere stijging per beurt, en een grotere diameter dan de originele peptide alfa-helix, ' zegt Guichard.
Om te bepalen of oligourea echte peptidestructuren kunnen nabootsen, de onderzoekers maakten peptide-oligoureumhybriden en onderzochten hun binding aan doeleiwitten. Een van de doelen, MDM2, is een natuurlijke regulator van het tumorsuppressoreiwit p53. De andere, VDR, is een eiwit dat nodig is bij de regulatie van celgroei, immuniteit, en andere biologische functies.
Voor de MDM2-bindende peptide-nabootsing, de onderzoekers maakten hybriden door drie terminale sleutelaminozuren te vervangen door ureido-eenheden. Voor de VDR-bindende peptide-nabootsing, ze vervingen het middelste aminozuursegment door ureido-eenheden. Na enkele optimalisatierondes, de auteurs vonden hybride structuren met hoge bindingsaffiniteiten.
De bindingsaffiniteiten waren vergelijkbaar met die van de oorspronkelijke peptiden. Bovendien, Röntgenanalyse onthulde dat de hybride structuren een regelmatige spiraalvormige structuur aannamen. Echter, de helices waren nog steeds een beetje breder en hadden grotere ruimtes tussen de zijketens langs de oligourea-ruggengraat dan die van natuurlijke peptiden.
Van peptide-oligoureumhybriden wordt verwacht dat ze weerstand bieden aan proteolytische afbraak, een belangrijk doel in de medicinale chemie. Een ander voordeel is dat ze meer aanpassingen mogelijk maken. "Alfa-aminozuren kunnen op twee posities worden gesubstitueerd, maar ureido-eenheden hebben één site meer, ", zegt Guichard. Dit betekent dat hybride peptide-oligoureumgeneesmiddelen meer opties voor optimalisatie bieden.
 Vooruit of achteruit? Nieuwe routes voor protonen in water of methanol
Vooruit of achteruit? Nieuwe routes voor protonen in water of methanol Antidegranulatie en galzuurbindende activiteit van fruit en agro-industriële bijproducten
Antidegranulatie en galzuurbindende activiteit van fruit en agro-industriële bijproducten Hoe katoenen watten te steriliseren voor een labklasse
Hoe katoenen watten te steriliseren voor een labklasse  Lichtgevoelige toplaag van plastic folie zorgt voor beweging
Lichtgevoelige toplaag van plastic folie zorgt voor beweging MXene-materialen helpen fotodetectoren het licht te zien
MXene-materialen helpen fotodetectoren het licht te zien
 Waarom zijn panda's met uitsterven bedreigde dieren?
Waarom zijn panda's met uitsterven bedreigde dieren?  Afvloeiing uit landbouw draagt bij aan opwarming van de aarde, maar een nieuwe studie biedt inzicht in de mitigatie van klimaatverandering
Afvloeiing uit landbouw draagt bij aan opwarming van de aarde, maar een nieuwe studie biedt inzicht in de mitigatie van klimaatverandering Langer modderseizoen, geen sneeuw zou de noordoostelijke rivieren kunnen veranderen tegen het jaar 2100
Langer modderseizoen, geen sneeuw zou de noordoostelijke rivieren kunnen veranderen tegen het jaar 2100 De vierde landbouwrevolutie komt eraan, maar wie heeft er echt baat bij?
De vierde landbouwrevolutie komt eraan, maar wie heeft er echt baat bij? Wat is het verschil tussen gevaarlijk afval en vast afval?
Wat is het verschil tussen gevaarlijk afval en vast afval?
Hoofdlijnen
- Vrijlating van hagedissen brengt zeldzame soorten terug naar hun natuurlijke habitat in Groot-Brittannië
- Wetenschappers nemen de temperatuur van knokkelkoorts risico
- 7 soorten bindweefsel
- Benchmarking computationele methoden voor metanomen
- Zeldzame olifanten redden met toeristische kiekjes
- Wat wordt geoxideerd en wat wordt er gereduceerd in celademhaling?
- Tijger botten? Leeuw botten? Een bijna uitgestorven cycad? DNA-controles ter plaatse bij aankomsthavens
- Ontdekking:Bernie Sanders spin
- 'S Werelds oudste bevroren sperma werkt prima
 Bloedplaatjes in plaats van bollen maken schermen zuiniger
Bloedplaatjes in plaats van bollen maken schermen zuiniger Algoritmen hebben de menselijke besluitvorming al overgenomen
Algoritmen hebben de menselijke besluitvorming al overgenomen Uit nieuw onderzoek blijkt dat taxichauffeurs hun inkomsten verbeteren door ritselectie
Uit nieuw onderzoek blijkt dat taxichauffeurs hun inkomsten verbeteren door ritselectie Het bos van de Mont Ventoux – een natuurlijk laboratorium om de effecten van klimaatverandering te bestuderen
Het bos van de Mont Ventoux – een natuurlijk laboratorium om de effecten van klimaatverandering te bestuderen Koolstofvrij elektrisch vervoer is al binnen bereik voor kleine eilanden
Koolstofvrij elektrisch vervoer is al binnen bereik voor kleine eilanden Ontdekken wat durian doet stinken
Ontdekken wat durian doet stinken Visschubben kunnen draagbare elektronica duurzamer maken
Visschubben kunnen draagbare elektronica duurzamer maken Materialen uit het ruimtetijdperk, één atoomlaag tegelijk
Materialen uit het ruimtetijdperk, één atoomlaag tegelijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com