
Wetenschap
T-celreceptoren uitrusten om een wijdverbreid en soms dodelijk virus te bestrijden
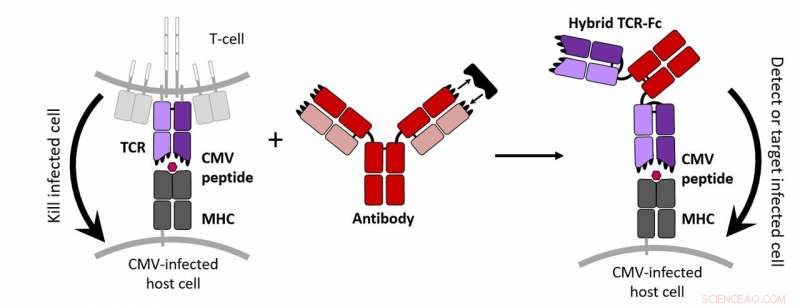
T-cellen zijn bedreven in het doden van met cytomegalovirus (CMV) geïnfecteerde cellen dankzij een T-celreceptor (TCR) die intracellulaire CMV-geassocieerde eiwitten herkent die op het celoppervlak worden gepresenteerd. Daarentegen, antilichamen zweven vrij door het lichaam, hecht zich stevig aan uitgescheiden en membraaneiwitten en tagt ze voor herkenning door andere immuuncellen. Dit werk combineerde de celtargeting-eigenschappen van een TCR en de hechte binding van een antilichaam met andere modificaties om een nieuw molecuul te creëren dat in staat is om CMV-geïnfecteerde cellen te detecteren en te labelen. Dit hybride eiwit vertegenwoordigt een nieuwe strategie om CMV-geïnfecteerde cellen te identificeren en mogelijk te elimineren. Krediet:Jennifer Maynard/Ellen Wagner/Universiteit van Texas
Onderzoekers hebben "antilichaamachtige" T-celreceptoren ontwikkeld die specifiek kunnen hechten aan cellen die zijn geïnfecteerd met cytomegalovirus, of CMV, een virus dat bij meer dan de helft van alle volwassenen op de leeftijd van 40 een levenslange infectie veroorzaakt. Deze receptoren vormen een nieuwe mogelijke behandelingsoptie, zou de ontwikkeling van CMV-vaccins kunnen helpen en zou ook kunnen worden gebruikt om hersentumoren aan te pakken.
In het gezonde immuunsysteem CMV sluimert terwijl T-cellen door het lichaam circuleren en geïnfecteerde cellen detecteren. Terwijl antilichamen alleen eiwitten op het oppervlak van cellen herkennen, T-cellen gebruiken hun membraangebonden T-celreceptoren, of TCR's, om ziektegerelateerde eiwitten te detecteren die zich in het celmembraan verbergen. TCR's kunnen dan T-cellen vertellen om de geïnfecteerde cel te vernietigen, wat normaal gesproken het geval is bij CMV. Echter, voor immuungecompromitteerde patiënten, dit verdedigingsmechanisme is sterk verminderd en het virus kan levensbedreigend worden.
Onderzoekers hebben eerder T-cellen gebruikt om ziekten te behandelen, maar het engineeren en transplanteren van hele T-cellen is zowel duur als invasief. In een nieuwe studie gepubliceerd in de Tijdschrift voor biologische chemie , een team van ingenieurs koos voor een alternatieve aanpak, het produceren van CMV-detecterende TCR's die, zoals antilichamen, zweven vrij door het lichaam en binden stevig aan hun zieke doelen.
"Op dit moment hebben we een molecuul dat eruitziet als een antilichaam, maar het bindt aan een (CMV-geassocieerd) peptide dat normaal gesproken zou worden herkend door een TCR, " zei Jennifer Maynard, een professor in chemische technologie aan de Universiteit van Texas in Austin en senior auteur van de studie. "Antilichamen hebben normaal geen toegang tot deze moleculen, dus dat is een groot probleem."
Om therapeutische biomoleculen te produceren, onderzoekers gebruiken vaak bacterie- of gistcellen als miniatuurfabriekjes. Echter, die celtypen hebben minimaal succes gehad bij het genereren van stabiele menselijke TCR's. Omdat de receptoren in zoogdiercellen zijn geëvolueerd, de moleculaire machinerie van vreemde celtypes introduceert vaak defecten, zei Maynard. Om de TCR's een meer geschikte omgeving te bieden, de auteurs gebruikten eierstokcellen van Chinese hamsters.
"Deze eiwitten zijn echt moeilijk om mee te werken, dus we dachten dat we ze gewoon in de omgeving zouden houden waar ze gelukkig zijn, en ze zijn gelukkig op het oppervlak van een zoogdiercel, ' zei Maynard.
TCR's creëren van nature losse banden met hun doelen, maar de auteurs wilden dat die van hen zich zouden binden en niet loslaten. Om deze verbindingen te versterken, de auteurs muteerden willekeurig het DNA van de TCR-component die het CMV-peptide detecteert. Vervolgens plaatsten ze vele versies van het gemuteerde DNA in hamstercellen, die toen ongeveer een miljoen verschillende soorten TCR produceerde, zei Maynard.
De onderzoekers bepaalden vervolgens welke gemuteerde versie de sterkste binding tot stand bracht door de talloze TCR-variaties die op het oppervlak van de hamstercellen tot expressie werden gebracht, bloot te stellen aan het CMV-peptide.
"We hebben er een gevonden die onze favoriet was, " Zei Maynard. "We hebben de bindingsaffiniteit 50-voudig verbeterd."
Vervolgens was de uitdaging om de TCR's van het T-celmembraan te bevrijden. Om dit te behalen, de onderzoekers bewerkten het DNA verder zodat de TCR's zich zouden hechten aan het eiwit dat de stengel van "Y"-vormige antilichamen vormt. En om deze eiwitten te helpen hun vorm te behouden, ze voegden een binding toe in de TCR en verhinderden ook dat suikers zich zouden hechten. Allemaal samen, deze veranderingen leken de slag te slaan, zei Maynard.
Deze "antilichaam-achtige" TCR's kunnen worden gebruikt om ziekteprogressie bij patiënten te volgen of om te evalueren hoe goed zich ontwikkelende vaccins werken. Deze TCR's kunnen ook een deel van de verloren immuunrespons herstellen bij immuungecompromitteerde patiënten door hun cellen te instrueren om CMV-infecties aan te vallen, zei Maynard.
Een andere grote kans voor dit nieuwe molecuul is de behandeling van glioblastoom. Hoewel de hersentumoren niet veel verschillende markers produceren, ze onderdrukken het immuunsysteem, die bij CMV-geïnfecteerde patiënten het virus weer tot leven kunnen brengen in de kankercellen, zei Maynard.
"Ons eiwit kan worden gebruikt om specifiek gericht te zijn op glioblastoomcellen, en het zou een zeer unieke marker opleveren, "Zei Maynard. "We zouden dit gebruiken om sommige van die tumorcellen te controleren of te doden."
 Een watersplitsende katalysator als geen ander
Een watersplitsende katalysator als geen ander ArtSea Ink:een kleurrijke, Op zeewier gebaseerde inkt voor 3D-printen
ArtSea Ink:een kleurrijke, Op zeewier gebaseerde inkt voor 3D-printen Het belang van Boyles Gas Law in het dagelijks leven
Het belang van Boyles Gas Law in het dagelijks leven Functionele groepen vervangen door een gouden elektrode om de reactiviteit van een molecuul te regelen
Functionele groepen vervangen door een gouden elektrode om de reactiviteit van een molecuul te regelen Wetenschappers creëren een chemische methode voor het in kaart brengen van de ruimte en ontrafelen het mysterie van het getal van Mendelejev
Wetenschappers creëren een chemische methode voor het in kaart brengen van de ruimte en ontrafelen het mysterie van het getal van Mendelejev
 We zouden een nieuwe groene beweging kunnen stimuleren door te praten over energieverandering
We zouden een nieuwe groene beweging kunnen stimuleren door te praten over energieverandering Visteelt Basics
Visteelt Basics  Het behalen van duurzame ontwikkelingsdoelen vereist meer samenwerking tussen disciplines
Het behalen van duurzame ontwikkelingsdoelen vereist meer samenwerking tussen disciplines Koudegolf onthult potentiële voordelen van stedelijke hitte-eilanden
Koudegolf onthult potentiële voordelen van stedelijke hitte-eilanden Asymmetrie in de uitstoot en verwijdering van kooldioxide kan klimaatdoelen scheeftrekken:onderzoek
Asymmetrie in de uitstoot en verwijdering van kooldioxide kan klimaatdoelen scheeftrekken:onderzoek
Hoofdlijnen
- Wat is de fysieke expressie van een allel?
- Honden likken hun mond om te communiceren met boze mensen
- Waarom zijn mensen altruïstisch?
- Hoe worden nieuwe cellen geproduceerd?
- Radiometrische datering: definitie, hoe werkt het, gebruik & voorbeelden
- Twee soorten spitssnuitdolfijnen duren erg lang, diepe duiken voor hun grootte
- Waarom blijven liedjes in mijn hoofd hangen?
- Rapport identificeert manieren om de commerciële vissersvloot van Alaska te verjongen
- Boek beschrijft alle 451 families van bloeiende planten, varens, lycopoden en naaktzadigen
- De natuur nabootsen voor programmeerbare en adaptieve synthetische materialen

- Wat zijn de verschillen tussen oplosbaarheid en mengbaarheid?

- Q&A:Op weg naar een nieuwe manier om zonnecellen te produceren
- Onderzoekers ontwikkelen verbeterd recyclingproces voor koolstofvezels

- De toekomst van plastic:het slechte hergebruiken en het goede aanmoedigen

 Nieuwe kaart belicht de zinkende kust van Louisiana
Nieuwe kaart belicht de zinkende kust van Louisiana NASA's nieuwe asteroïde-waarschuwingssysteem geeft vijf dagen waarschuwing
NASA's nieuwe asteroïde-waarschuwingssysteem geeft vijf dagen waarschuwing De wetenschap lijdt bijkomende schade als de VS, Spanningen in China lopen op
De wetenschap lijdt bijkomende schade als de VS, Spanningen in China lopen op 3D print je eigen Marsrover met ExoMy
3D print je eigen Marsrover met ExoMy Historisch gezien geven zwarte hogescholen afgestudeerden een loonsverhoging
Historisch gezien geven zwarte hogescholen afgestudeerden een loonsverhoging Te midden van landelijke droogte, Rome zoekt naar manieren om rantsoenering te vermijden
Te midden van landelijke droogte, Rome zoekt naar manieren om rantsoenering te vermijden Aardbevingsfysica op meerdere schalen
Aardbevingsfysica op meerdere schalen Efficiëntere brandstofceltoepassingen via nanotechnologie
Efficiëntere brandstofceltoepassingen via nanotechnologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

