
Wetenschap
Molecuulstudies onthullen mogelijke behandeling voor patiënten met een beroerte
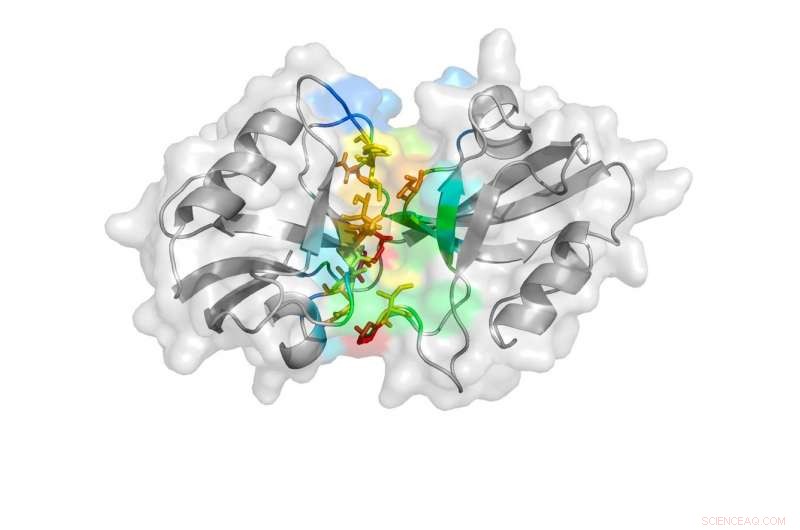
Een cartoonweergave die door het onderzoek is onthuld, toont de gesloten toestand van de PDZ-domeinen. Credit: Natuurcommunicatie , doi:10.1038/s41467-018-06133-0
In een uitbreiding van een maand geleden gepubliceerd onderzoek in Natuurmethoden , een nieuwe hybride benadering uitgevoerd door onderzoekers van de afdeling natuurkunde en astronomie van Clemson University en Stony Brook University heeft een 3D-structuur van een eiwitfragment onthuld dat zou kunnen dienen als een medicijndoelwit bij de behandeling van patiënten met een beroerte.
Het eiwit dat "postsynaptische dichtheidseiwit van 95 kDa (PSD-95)" wordt genoemd, bevindt zich op neuronen in de hersenen die chemische berichten - neurotransmitters - ontvangen van aangrenzende neuronen. Door receptoren en andere helper-eiwitten te rekruteren, PSD-95 werkt om de integriteit van neurale verbindingen in de loop van de tijd te behouden, waardoor neurale communicatie wordt vergemakkelijkt, leren en geheugen.
PSD-95 bestaat uit vijf delen, of domeinen, die elk een andere rol spelen in de algemene functie van het eiwit. Twee van deze domeinen, genaamd PDZ-1 en PDZ-2, waarvan is aangetoond dat ze de symptomen beïnvloeden die gepaard gaan met ischemische beroerte, zoals verlamming of spraakstoornis.
"Een van de ideeën die in de literatuur zijn gepostuleerd, is om een multivalent medicijn te maken dat zich richt op beide PDZ-domeinen, omdat ze erg op elkaar lijken. Als je kunt voorkomen dat de PDZ-domeinen bepaalde eiwitten of enzymen binden, u de slopende effecten van een beroerte kunt verminderen, " zei Hugo Sanabria, hoofdauteur van het onderzoek.
De uitdaging, echter, is dat het bijna onmogelijk is om een medicijnremmer te ontwerpen zonder eerst de exacte structuur van de PDZ-domeinen van PSD-95 te kennen. Het zou zijn alsof je door het land rijdt zonder een kaart van de Verenigde Staten te hebben.
"De biologische functies van biomoleculen worden bepaald door hun structuren, dus we hebben gedetailleerde structurele en dynamische inzichten nodig van PDZ-1 en -2 om hun functionele rol beter te begrijpen en om te helpen bij het ontwerpen van nieuwe remmers, " zei Feng Ding, Sanabria's collega hier bij Clemson.
Er bestaat een handvol benaderingen om de structuur van biomoleculen weer te geven. Maar in het geval van PSD-95, elke benadering - NMR-spectroscopie, Röntgenkristallografie en Förster-resonantie-energieoverdracht (FRET) - leverden een ander structureel model op. De medewerker van de onderzoekers aan de Stony Brook University, universitair hoofddocent Mark Bowen bij de afdeling fysiologie en biofysica, ging een partnerschap aan met Sanabria voor dit project nadat hij een van de inconsistente structurele modellen van het PSD-95-fragment had ontdekt.
Het laboratorium van Sanabria heeft deze discrepantie aangepakt door eerst het PSD-95-fragment te modelleren met FRET, een benadering die mogelijke configuraties van biomoleculen identificeert. Onder deze methode, Sanabria bevestigde twee lichtgevoelige moleculen, genaamd chromoforen, op twee verschillende posities op het PSD-95-fragment. Vervolgens ontdekte hij de afstand tussen de chromoforen door het fragment onder een microscoop te visualiseren. Dit werd meerdere keren herhaald vanaf verschillende bevestigingspunten.
"Voor het modellerende aspect, FRET geeft je afstanden tussen chromoforen, maar dat is niet genoeg om alle geometrische beperkingen van het molecuul te vullen, dus we moeten op iets anders vertrouwen, een andere methodiek. Dat is waar professor Ding in het spel komt, ' zei Sanabria.
Ding leidt een computationeel biofysica-lab aan de Clemson University, waar hij computersoftware gebruikt om te meten hoe biomoleculen eruitzien. bewegen en functioneren. Zijn benadering van modellering maakt gebruik van een computersimulatie die bekend staat als discrete moleculaire dynamica (DMD) die het landschap van een biomolecuul in kaart brengt, het voorspellen van de banen van eiwitten terwijl ze vouwen en interageren met andere moleculen. De daaropvolgende simulatie kan worden afgespeeld als een film, het helpen van onderzoekers om eiwitgedrag in de loop van de tijd te visualiseren.
"Als je traditionele moleculaire simulaties doet, meestal ga je een heel klein deel van de ruimte bemonsteren, vooral voor grotere moleculen, dus je zult geen goed overzicht hebben van hoe het hele molecuul eruit zal zien, zelfs in fysiologische omstandigheden, " zei Sanabria. "Discrete moleculaire dynamica is een veel snellere en minder rekenkundige dure manier om de conformationele ruimte van eiwitten nauwkeurig en snel te bemonsteren."
Om het te doen, Sanabria verkreeg eerst een reeks afstanden door PSD-95 te meten met FRET. Bij dat experiment Sanabria had 10 monsters van het PSD-95-fragment die elk verschillende afstanden opleverden en er werden drie gemeenschappelijke vormen - of conformaties - van PSD-95 waargenomen. Nog, zonder een DMD-simulatie, de onderzoekers konden op geen enkele manier weten welke afstand overeenkwam met welke conformatie van het fragment. Ze voeren dus elke mogelijke afstand in tegen elke mogelijke vorm en laten de simulatie de rest doen.
"Toen we de eerste simulatie deden, we zagen dat er drie hoofdstaten waren die PDZ-1 en -2 gebruikten. Eén toonde zeer nauw contact tussen de twee, één toonde een set van tussentijds contact en één had helemaal geen contact, ' zei Ding.
De onderzoekers voerden vervolgens opnieuw een DMD-simulatie uit zonder rekening te houden met de FRET-afstanden om te bevestigen dat de drie waargenomen toestanden in de natuur bestaan en niet alleen een toevalstreffer zijn die wordt opgelegd door de FRET-afstanden. Ze onderzochten de structuren verder door te kijken naar de manier waarop individuele aminozuren, die de PDZ-domeinen vormen, band met elkaar. Uit deze analyses Ding, Bowen en Sanabria konden bevestigen dat de PDZ-domeinen twee van de drie waargenomen toestanden in de DMD-simulatie aannemen - dat met enig contact en dat met helemaal geen contact.
"Nutsvoorzieningen, we hebben twee potentiële doelwitten voor het ontwikkelen van nieuwe medicijnen die efficiënter zullen zijn dan de momenteel beschikbare medicijnen, " zei Sanabria. "De vooruitzichten voor patiënten met een beroerte zijn veelbelovend."
Zonder discrete moleculaire dynamica, die conformatieveranderingen kan vastleggen die optreden op de microseconde tijdschaal, deze twee staten zouden net als in eerdere studies gemist zijn.
"De meeste mensen die FRET-geleide structurele modellering doen, werken met een rigide molecuul, zoals DNA. Als je een rigide molecuul hebt, het is gemakkelijk te modelleren:je hoeft maar één staat vast te leggen. U kunt de FRET-afstanden toewijzen en er is echt geen probleem, ' zei Sanabria. 'In dit geval, we hebben deze aanpak op veel manieren overtroffen."
In toekomstige studies, het team is op zoek naar het potentieel voor het PSD-95-fragment om zichzelf automatisch te remmen op basis van de eigen structuur van het fragment.
 Tale of the tape:plakkerige stukjes zorgen voor betere batterijen
Tale of the tape:plakkerige stukjes zorgen voor betere batterijen Gerecycled beton kan een duurzame manier zijn om puin van stortplaatsen te houden
Gerecycled beton kan een duurzame manier zijn om puin van stortplaatsen te houden Houd het simpel:het synthetiseren van nuttige organische verbindingen is nu gemakkelijker en goedkoper gemaakt
Houd het simpel:het synthetiseren van nuttige organische verbindingen is nu gemakkelijker en goedkoper gemaakt Onderzoekers creëren kunstkraakbeen dat zichzelf kan herstellen
Onderzoekers creëren kunstkraakbeen dat zichzelf kan herstellen De weg vrijmaken voor kunstmatige fotosynthese:effect van doping op de fotokatalysator SrTiO3
De weg vrijmaken voor kunstmatige fotosynthese:effect van doping op de fotokatalysator SrTiO3
 Oude menselijke verstoringen kunnen het begrip van Amazon en de impact ervan scheeftrekken (update)
Oude menselijke verstoringen kunnen het begrip van Amazon en de impact ervan scheeftrekken (update) Nieuw onderzoek wijst op uitdagende aard van gevestigde belangen in de energietransitie
Nieuw onderzoek wijst op uitdagende aard van gevestigde belangen in de energietransitie De meeste voedseluitgaven ondersteunen de verwerking, geen boeren:studeren
De meeste voedseluitgaven ondersteunen de verwerking, geen boeren:studeren De impact van technologische materialen voor de koolstofarme transitie beperken
De impact van technologische materialen voor de koolstofarme transitie beperken Minimum Arctisch zee-ijs 2019 gelijkgesteld voor op één na laagste ooit
Minimum Arctisch zee-ijs 2019 gelijkgesteld voor op één na laagste ooit
Hoofdlijnen
- Hoe virussen de manier veranderen waarop we naar evolutie kijken
- Kun je verslaafd zijn aan endorfine?
- Tropische kevers worden met uitsterven bedreigd
- Waarom het zo moeilijk is om schepen bij te houden die niets goeds doen?
- Onderzoek naar klimaatverandering van de achteruitgang van de jongen van lederschildpadden levert geen antwoorden op
- Heb je testangst? Hier is hoe we het moeten aanpakken
- Hoe meet je geluk?
- Het Bohr-model:snel vervangen maar nooit vergeten
- Hoe CIPA werkt
- Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren
- Nieuw 2D metalen organisch raamwerk met interessante elektrische geleidbaarheid en magnetische eigenschappen
- Bio-geïnspireerde microvasculatuur gebruiken om materiaaleigenschappen te beheersen
- Nieuwe symmetriedoorbrekende methode opent weg voor bioactieve stoffen

- Verschillende delen van een kwikthermometer

 Met stijgende zeespiegels, Bangkok worstelt om overeind te blijven
Met stijgende zeespiegels, Bangkok worstelt om overeind te blijven Nog een kans voor de laatste man die in Dundee is opgehangen?
Nog een kans voor de laatste man die in Dundee is opgehangen? Hot qubits doorbreken een van de grootste beperkingen voor praktische kwantumcomputers
Hot qubits doorbreken een van de grootste beperkingen voor praktische kwantumcomputers Nieuwe tool dient als digitaal logboek voor dronegebruikers
Nieuwe tool dient als digitaal logboek voor dronegebruikers Biomassabrandstoffen kunnen de opwarming van de aarde aanzienlijk verminderen
Biomassabrandstoffen kunnen de opwarming van de aarde aanzienlijk verminderen Onderzoek naar dichte plasma's met positronengolven
Onderzoek naar dichte plasma's met positronengolven Handelsregels komen naar voren als wapen om klimaatverandering in Europa te bestrijden
Handelsregels komen naar voren als wapen om klimaatverandering in Europa te bestrijden Biodiversiteitsverlies door diepzeemijnbouw zal onvermijdelijk zijn
Biodiversiteitsverlies door diepzeemijnbouw zal onvermijdelijk zijn
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

