
Wetenschap
Nieuwe symmetriedoorbrekende methode opent weg voor bioactieve stoffen

Een demonstratie van moleculaire chiraliteit met behulp van 3D-atoommodellen in het laboratorium. Krediet:J. Waser/EPFL
Veel chemische moleculen kunnen samen met hun spiegeltegenhangers in de natuur voorkomen; zoals handen, twee verbindingen kunnen bestaan uit dezelfde atomen in dezelfde algemene structuur maar in tegengestelde oriëntaties, d.w.z. linkshandig en rechtshandig. Dit fenomeen van symmetrie wordt "chiraliteit" genoemd, en kan spiegeltegenhangers ("enantiomeren") totaal verschillende chemische eigenschappen geven. Een beroemd en tragisch voorbeeld van chiraliteit is thalidomide, die oorspronkelijk werd verkocht als een mengsel van beide enantiomeren. Het probleem was dat de ene een onschadelijk kalmerend middel was en de andere zeer giftig voor foetussen. resulterend in verontrustende aangeboren misvormingen.
Dus vandaag is het noodzakelijk geworden om verbindingen te synthetiseren met wat bekend staat als een hoge "optische zuiverheid", wat een maat is voor chirale zuiverheid:de mate waarin een monster één enantiomeer in grotere hoeveelheden bevat dan het andere. Maar omdat enantiomeren zeer kleine structurele verschillen en identieke stabiliteit hebben, het synthetiseren van de ene over de andere is een zeer uitdagende taak.
Een manier om dit te doen is wat chemici "desymmetrisatie" noemen van een niet-chirale verbinding die vergelijkbaar is met het doelmolecuul. Dit houdt in dat een molecuul wordt aangepast zodat het de symmetrie-elementen verliest die ervoor zorgden dat het niet chiraal was.
Onderzoekers van Jérôme Waser's Laboratory of Catalysis and Organic Synthesis bij EPFL hebben nu een nieuwe desymmetrisatiestrategie ontwikkeld om toegang te krijgen tot chirale bouwstenen die ureumsubstructuren bevatten. Ureumderivaten zijn belangrijke componenten van biomoleculen zoals biotine (vitamine B7) of bioactieve natuurlijke producten, zoals het antikanker agelastatine A.
De onderzoekers deden twee cruciale innovaties. Eerst, ze ontwierpen een niet-chirale cyclopropaan (drieledige koolstofring) voorloper. Dit molecuul biedt een verhoogde reactiviteit en is ideaal voor reacties onder milde omstandigheden.
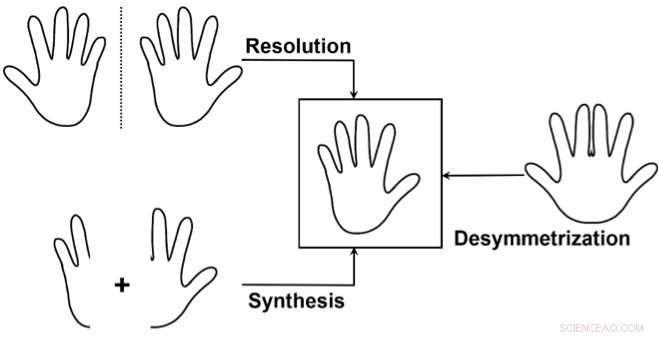
De drie belangrijkste benaderingen om selectief toegang te krijgen tot één enantiomeer:1) Scheid een mengsel van de twee enantiomeren (resolutie), een van de enantiomeren verspillen. 2) Synthetiseer selectief slechts één van de twee enantiomeren. 3) Gebruik een "desymmetrisatie" van een niet-chirale verbinding die vergelijkbaar is met het doelwit. Dit wordt minder vaak gebruikt, maar het is bijzonder elegant omdat het chiraliteit van een toch al relatief complexe voorloper kan onthullen door de symmetrie in slechts één eenvoudige transformatie te doorbreken. Krediet:J. Waser/EPFL
Tweede, de onderzoekers ontwikkelden een nieuwe koperkatalysator die met hoge selectiviteit een enantiomeer van het gewenste product kan vormen. Het kopercentrum bindt en activeert de cyclopropaanprecursor, waardoor zijn banden breken. De voorloper wordt dan aangevallen door een indool, een molecuul dat erg belangrijk is als structureel element van bioactieve verbindingen. Als resultaat, de voorloper verliest zijn symmetrie - en wordt daarom chiraal - en kan worden gebruikt om selectief het gewenste enantiomeer te maken.
Het werk is een belangrijke doorbraak, omdat desymmetrisatie nooit eerder is gebruikt om toegang te krijgen tot chirale ureums uit cyclopropanen. "Nieuwe bouwstenen zijn nu gemakkelijk toegankelijk als pure enantiomeren, en kan worden getest op biologische activiteit of worden gebruikt om complexere chirale moleculen te synthetiseren, " zegt Jérôme Waser. "Bovendien, de nieuwe katalysator die we hebben ontworpen zal zeker bruikbaar zijn voor andere toepassingen in de synthetische chemie."
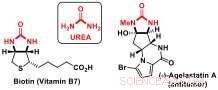
Urea:belangrijke bouwstenen van bioactieve moleculen. Krediet:J. Waser/EPFL
 Het wateroppervlak is een fantastische plek voor chemische reacties
Het wateroppervlak is een fantastische plek voor chemische reacties Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker
Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker Een tango met verwarde polymeren
Een tango met verwarde polymeren Team ontwikkelt gasdetectietechnologie die een revolutie teweeg kan brengen in de milieu- en medische diagnostiek
Team ontwikkelt gasdetectietechnologie die een revolutie teweeg kan brengen in de milieu- en medische diagnostiek De toevallige ontdekking van een nieuwe groene chemiemethode
De toevallige ontdekking van een nieuwe groene chemiemethode
 Koeien ademen veel methaan uit, maar rundvlees belasten zal de uitstoot niet verminderen
Koeien ademen veel methaan uit, maar rundvlees belasten zal de uitstoot niet verminderen Dodental cycloon Zuid-Azië passeert 100
Dodental cycloon Zuid-Azië passeert 100 Californië wind, en brandgevaar, raakt ongekend hoog (Update)
Californië wind, en brandgevaar, raakt ongekend hoog (Update) Aanvullende Arctische weergegevens verhogen de voorspellingsnauwkeurigheid van koude golven in Japan
Aanvullende Arctische weergegevens verhogen de voorspellingsnauwkeurigheid van koude golven in Japan Hevige winterstorm in VS neemt af
Hevige winterstorm in VS neemt af
Hoofdlijnen
- 10 misvattingen over GGO's
- Maaien of niet maaien:Overlastgroei van waterplanten bij de wortel aanpakken
- De structuur en functie van spiercellen
- RNA-ontdekking kan de plantwarmte helpen verhogen, droogtetolerantie
- Hoeveel weegt het leven?
- Meer waarnemingen van een bedreigde diersoort betekent niet altijd dat deze zich herstelt
- Structuur van het spierstelsel
- Lantaarnvissen onthullen hoe de opwarming van de oceaan de schemerzone beïnvloedt
- Hoe te metaboliseren glucose om ATP te maken
Energie opgeslagen in de chemische bindingen van de koolhydraat-, vet- en eiwitmoleculen in levensmiddelen. Het proces van spijsvertering breekt koolhydraatmoleculen af in glucosemoleculen. Glucose die
- Ultrarekbare en vervormbare biosondes met Kirigami-ontwerpen

- Elementen gevonden in huishoudelijke producten

- Een oplossing aandrijven:professor neemt de leiding over het verbeteren van de veiligheid van lithium-ionbatterijen

- Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid
- Cyborg-bacteriën presteren beter dan planten wanneer ze zonlicht omzetten in nuttige verbindingen
 Werkzoekenden verbreken banden met ondersteunende collega's
Werkzoekenden verbreken banden met ondersteunende collega's De helderheid van Lake Tahoe zakt naar een historisch dieptepunt in 2017
De helderheid van Lake Tahoe zakt naar een historisch dieptepunt in 2017 Is methaan niet-polair?
Is methaan niet-polair?  Weet u waarom en hoe u wachtwoorden vergeet?
Weet u waarom en hoe u wachtwoorden vergeet? Elon Musk geeft details vrij van plan om Mars te koloniseren - dit is wat een planetaire expert denkt
Elon Musk geeft details vrij van plan om Mars te koloniseren - dit is wat een planetaire expert denkt Statistieken onthullen nieuwe, nauwkeuriger inzicht in opwaartse mobiliteit tussen generaties
Statistieken onthullen nieuwe, nauwkeuriger inzicht in opwaartse mobiliteit tussen generaties Nanometrische vlindervleugels gemaakt
Nanometrische vlindervleugels gemaakt Nanostructuren zouden veilig een notoir kwetsbaar medicijn kunnen leveren aan coronavirus
Nanostructuren zouden veilig een notoir kwetsbaar medicijn kunnen leveren aan coronavirus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

