
Wetenschap
Team bereikt chemische reacties met twee elektronen met behulp van lichtenergie, goud
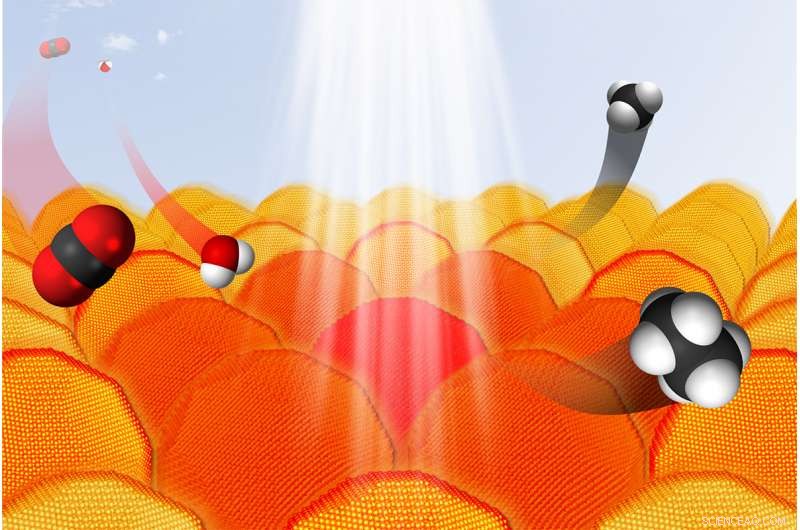
Onder de juiste omstandigheden, gouden nanodeeltjes absorberen licht en dragen elektronen over aan andere reactanten. Dit proces kan worden gebruikt om CO2 en water om te zetten in koolwaterstoffen. In de grafiek, koolstofatomen zijn zwart, zuurstofatomen zijn rood en waterstofatomen zijn wit. Krediet:Sungju Yu/Jain Lab/Universiteit van Illinois
Wetenschappers zijn een stap dichter bij het bouwen van een koolstofrecyclingsysteem dat zonne-energie kan oogsten om CO2 en water efficiënt om te zetten in vloeibare brandstoffen. Door vele onderdelen van het systeem te optimaliseren, zeggen de onderzoekers, ze kunnen nu chemische reacties met twee elektronen aansturen, een aanzienlijke vooruitgang ten opzichte van reacties met één elektron, die energie-inefficiënt zijn.
Het onderzoek, gerapporteerd in het journaal Natuurchemie , zal diegenen helpen die een manier willen vinden om overtollig koolstofdioxide in de atmosfeer om te zetten in bruikbare energiebronnen, zei professor chemie van de Universiteit van Illinois, Prashant Jain, die het nieuwe onderzoek leidde.
"Wetenschappers kijken vaak naar planten voor inzicht in methoden om zonlicht om te zetten, kooldioxide en water in brandstoffen, " hij zei.
Wanneer zonne-energie plantenbladeren raakt, het prikkelt de elektronen in chlorofyl. Die opgewonden elektronen drijven uiteindelijk de chemie aan die koolstofdioxide en water omzet in glucose.
"Veel van deze chemische reacties zijn multiproton, multi-elektron reacties, ' zei Jaïn.
Maar in plaats van te vertrouwen op biologisch afbreekbare plantenpigmenten om lichtenergie om te zetten in chemische energie, wetenschappers wenden zich tot iets beters:elektronenrijke metaalkatalysatoren zoals goud, die bij specifieke lichtintensiteiten en golflengten foto-geëxciteerde elektronen en protonen kunnen overbrengen naar reactanten zonder te worden afgebroken of opgebruikt.
"In onze studie we gebruikten bolvormige gouddeeltjes van 13 tot 14 nanometer groot, Jain zei. "De nanodeeltjes hebben unieke optische eigenschappen, afhankelijk van hun grootte en vorm."
Wanneer gecoat met een polymeer en gesuspendeerd in water, bijvoorbeeld, de nanodeeltjes absorberen groen licht en reflecteren een dieprode kleur. Onder lichte opwinding, de nanodeeltjes dragen elektronen over aan sondemoleculen, die dan van kleur veranderen. Hierdoor kunnen wetenschappers meten hoe efficiënt de elektronenoverdrachtsreacties plaatsvinden.
"Onderzoekers zijn er in het verleden in geslaagd om fotochemie en deze lichtabsorberende materialen te gebruiken om één elektron tegelijk over te brengen, "Zei Jain. "Maar in de nieuwe studie, we hebben de principes en regels en voorwaarden geïdentificeerd waaronder een metalen nanodeeltjeskatalysator twee elektronen tegelijk kan overbrengen."
Door de intensiteit van het in de experimenten gebruikte laserlicht te variëren, Jain en zijn collega's ontdekten dat bij vier tot vijf keer de intensiteit van zonne-energie, de gouden nanodeeltjes in het systeem kunnen tot twee elektronen tegelijk van ethanol naar een elektronenhongerige sonde overbrengen.
Twee-elektronreacties hebben verreweg de voorkeur boven één-elektronreacties, zei Jaïn.
"Je hebt een elektronenpaar nodig om een binding tussen atomen te maken, " zei hij. "Als je geen elektronenpaar levert - en een paar protonen om het verlies van elektronen te neutraliseren - maak je uiteindelijk vrije radicalen, die zeer reactief zijn en terug kunnen reageren, het verspillen van de energie die je hebt gebruikt om ze te maken. Ze kunnen ook reageren met andere chemicaliën of je katalysator vernietigen."
Jain concludeerde ook dat recente experimenten die zijn laboratorium met hetzelfde systeem uitvoerde, ook multi-elektron, multiproton-overdrachten. Bij die experimenten zijn lab zette CO2 om in ethaan, een twee-koolstofverbinding die energierijker is dan methaan, die slechts één koolstof bevat. Jain en zijn collega's hopen uiteindelijk propaan te genereren, die een drie-koolstof ruggengraat heeft, en butaan, die er vier heeft.
"Vanuit het oogpunt van chemie, het is interessant om de regels te begrijpen voor het aan elkaar rijgen van koolstofatomen, "Zei Jain. "Door meer dan één elektron tegelijk over te brengen, het activeren van meer dan één kooldioxidemolecuul tegelijk aan het oppervlak van de nanodeeltjeskatalysator kan ons toegang geven tot hogere koolwaterstoffen."
Hoewel de nieuwe bevindingen een belangrijke stap voorwaarts betekenen, er moet nog veel meer werk worden verzet voordat deze technologie klaar is om te worden gebruikt en opgeschaald om de huidige uitdagingen aan te gaan, zei Jaïn.
"Er is nog een lange weg te gaan. Ik denk dat we minstens een decennium nodig zullen hebben om praktische CO2-vastlegging te vinden, CO2-fixatie, brandstofvormingstechnologieën die economisch haalbaar zijn, " zei hij. "Maar elk inzicht in het proces verbetert het tempo waarin de onderzoeksgemeenschap kan bewegen."
 Tweerichtingssymmetrie in de moleculaire fysica
Tweerichtingssymmetrie in de moleculaire fysica Gemakkelijke ontleding van metaal-NHC-complexen onder katalytische omstandigheden en de sleutelrol van NHC-gestabiliseerde nanodeeltjes
Gemakkelijke ontleding van metaal-NHC-complexen onder katalytische omstandigheden en de sleutelrol van NHC-gestabiliseerde nanodeeltjes Australische struik bevat nieuwe klasse organische verbindingen
Australische struik bevat nieuwe klasse organische verbindingen Waarom is het belangrijk om vertrouwd te zijn met laboratoriumapparatuur en hun gebruik?
Waarom is het belangrijk om vertrouwd te zijn met laboratoriumapparatuur en hun gebruik?  Evaporatie-experiment voor kinderen bekijken
Evaporatie-experiment voor kinderen bekijken
 Onderzoekers verbinden de gegevens om een versnellende trend voor mariene hittegolven in onze oceanen te laten zien
Onderzoekers verbinden de gegevens om een versnellende trend voor mariene hittegolven in onze oceanen te laten zien Hoe een skelet te behouden
Hoe een skelet te behouden  Reactieopties moeten centraal staan in de beoordeling en het beheer van klimaatrisico's
Reactieopties moeten centraal staan in de beoordeling en het beheer van klimaatrisico's Wetenschappers verbijsterd door kwik springen in vis uit Grote Meren
Wetenschappers verbijsterd door kwik springen in vis uit Grote Meren Psychologen richten zich op de oorzaak van bodemerosie
Psychologen richten zich op de oorzaak van bodemerosie
Hoofdlijnen
- Nieuw onderzoek onthult de enige tuimelaars in Engeland
- De vogels van een meedogenloos paradijs
- Van motief naar methode,
- Plankton zwemt tegen de stroom in
- DNA-labtechnieken pionier in New York nu onder vuur
- De functie van macromoleculen
- Gouden aardappel levert een overvloed aan vitamine A en E
- Hoe elektroforese te analyseren
- Zijn de hersenen bedraad voor religie?
- Onderzoekers isoleren waterstoffluoride en water om zuuroplossing te begrijpen
- Hoe zijn zuren en basen schadelijk?

- Veelbelovende ontdekking zou kunnen leiden tot een betere, goedkopere zonnecel

- Biochemici onthullen moleculair mechanisme voor regulatie van motoreiwitten
- Chemie:toegang tot verboden ringen
 Het beste van twee werelden:klassieke en kwantumsystemen combineren om aan de eisen van supercomputers te voldoen
Het beste van twee werelden:klassieke en kwantumsystemen combineren om aan de eisen van supercomputers te voldoen Amerikaanse productie zakt in recessie te midden van handelsoorlogen
Amerikaanse productie zakt in recessie te midden van handelsoorlogen NASA en MIT werken samen aan de ontwikkeling van een op de ruimte gebaseerde kwantum-dot-spectrometer
NASA en MIT werken samen aan de ontwikkeling van een op de ruimte gebaseerde kwantum-dot-spectrometer Elektronen-gatparen in tweedimensionale kristallen
Elektronen-gatparen in tweedimensionale kristallen De fysieke oorsprong van het geheugeneffect in een bril verklaren
De fysieke oorsprong van het geheugeneffect in een bril verklaren Tornado's scheuren door Tennessee, 25 doden
Tornado's scheuren door Tennessee, 25 doden Positieve effecten op het milieu door groen te worden
Positieve effecten op het milieu door groen te worden Robotbarman bewijst dat meer informatie niet leidt tot betere beslissingen
Robotbarman bewijst dat meer informatie niet leidt tot betere beslissingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

