
Wetenschap
Enzymenbeweging kan de sleutel zijn tot nieuwe kankermedicijnen
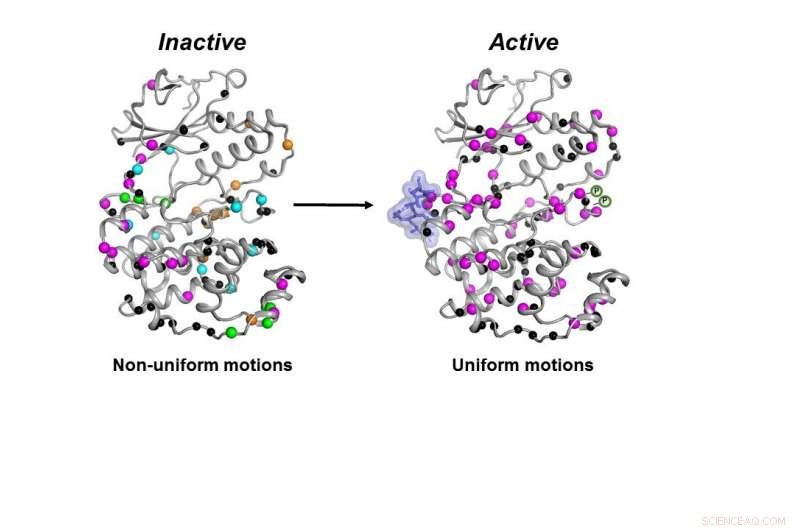
De inactieve vorm (links) van het MAPK p38-enzym beweegt op een ongecoördineerde manier. Zodra de benodigde moleculen (blauwe klodder en P-symbolen) binden, het enzym wordt actief (rechts) door op een gecoördineerde manier te bewegen om zijn werk in een cel te doen. Krediet:Senthil Ganesan, Universiteit van Arizona Afdeling Scheikunde en Biochemie.
Het onthullen van alle stappen die nodig zijn om een enzym, een proteïnekinase genaamd, te activeren, kan nieuwe manieren identificeren om kanker aan te pakken, volgens nieuw onderzoek onder leiding van de Universiteit van Arizona.
Niet alleen moet de kinase alle benodigde onderdelen op hun plaats hebben, het enzym moet op de juiste manier en met de juiste snelheid bewegen om goed te kunnen functioneren in een cel, vonden de onderzoekers.
Eerste auteur Senthil Kumar Ganesan, een UA-onderzoeksassistent-professor scheikunde en biochemie, genoemde kinasen zijn schakelaars die bepaalde cellulaire processen in- of uitschakelen. Als de kinasen van een cel niet meer werken, de cel zou sterven.
Het door de UA geleide team is de eerste groep die de volledige route voor het activeren van een proteïnekinase heeft ontdekt, zei senior auteur Wolfgang Peti, die de Homer C. en Emily Davis Weed Endowed Chair in Chemistry bekleedt aan de Universiteit van Arizona.
"Kinasen zijn een van de belangrijkste doelwitten voor kankergeneesmiddelen, " zei Piet, die ook lid is van het UA BIO5 Institute en het UA Cancer Center. "Als je weet hoe een kinase werkt, je kunt er zeker beter je medicijnen tegen ontwerpen."
Het ontwikkelen van een medicijn dat gebruik maakt van deze nieuwe onderzoeksbevinding zal waarschijnlijk minstens 10 jaar duren, hij zei.
Geneesmiddelen tegen kanker die al in gebruik zijn en gericht zijn op kinasen zijn dasatinib en imatinib voor chronische myeloïde leukemie en afatinib voor niet-kleincellig longcarcinoom, zei Ganesan.
Om een kinase genaamd mitogen-activated protein kinase (MAPK) p38 in actie te zien, de onderzoekers gebruikten nucleaire magnetische resonantie (NMR) spectroscopie.
Alle noodzakelijke moleculen moesten aan p38 binden om het enzym actief te laten worden. Alleen dan kan het enzym correct bewegen om zijn werk in de cel te doen, vonden de onderzoekers.
"We hebben uitgezocht hoe het beweegt om zijn werk te doen en wat de bijdrage is van de bewegingssnelheid aan zijn werk, ' zei Piet.
De bevinding suggereert dat een nieuwe weg voor het ontwikkelen van geneesmiddelen tegen kanker het creëren van medicijnen zou kunnen zijn die de beweging van p38 verstoren, hij zei.
"We zijn enthousiast omdat dit kinase behoort tot een familie van kinasen die MAP-kinasen worden genoemd - belangrijke signaalkinasen die een overvloed aan paden (in cellen) reguleren, " hij zei.
Peti zei dat de nieuwe bevinding van toepassing zou kunnen zijn op andere kinasen. Hij zei dat de vele kinase-enzymen in het lichaam erg op elkaar lijken en waarschijnlijk vergelijkbare paden naar activering hebben.
Ganesaan, Peti en hun co-auteurs publiceerden het artikel, "Dynamische activering en regulatie van het door mitogeen geactiveerde eiwitkinase p38, " in het nummer van 1 mei van de Proceedings van de National Academy of Sciences .
Hun co-auteurs zijn Michael W. Clarkson en Rebecca Page van de Universiteit van Arizona; Micha B.A. Kunze, Daniele Granata en Kresten Lindorff-Larsen van de Universiteit van Kopenhagen in Denemarken; en A. Joshua Wand van de Universiteit van Pennsylvania in Philadelphia.
De National Institutes of Health-beurs NIH-R01GM100910 financierde het onderzoek. De gegevens werden verzameld bij de UA Molecular Structures Core en Brown University Structural Biology Core-faciliteiten.
Een vaak gebruikte analogie voor de werking van enzymen is die van een slot en een sleutel. Een bepaald molecuul, de sleutel, past op een plaats in het enzym, het slot. Zodra de sleutel in het slot zit, het enzym kan gaan werken.
De sleutel in het slot is nodig om een enzym te laten werken, maar het activeren van een enzym is niet altijd zo eenvoudig. Sommige wetenschappers hebben gesuggereerd dat dynamiek - de manier waarop en de snelheid waarmee een enzym beweegt - belangrijk is voor het activeren van kinase-enzymen.
Peti is geïnteresseerd in hoe moleculen zoals kinasen processen met cellen besturen, daarom wilde hij de rol die dynamiek speelt onderzoeken. Door meer te leren over hoe moleculen in cellen functioneren, kunnen gerichte medicijnen worden ontwikkeld om kanker en andere ziekten te bestrijden.
Het uitzoeken van de rol die dynamiek speelt bij de activering van p38 was moeilijker en duurde langer dan hij had verwacht.
Het gereedschap dat wetenschappers gebruiken om een enzym in actie te zien, NMR-spectroscopie, is moeilijker met een groot molecuul zoals p38. In aanvulling, het team moest nieuwe computersoftware ontwikkelen om de resultaten te analyseren, zei Piet.
De onderzoekers keken naar het enzym gedurende een reeks stappen terwijl verschillende sleutelmoleculen aan p38 bonden. Sommige enzymen worden geactiveerd als sleutelmoleculen binden, maar deze niet.
"Als je denkt dat het een proces van vijf of zes stappen is om van nul naar 100 te gaan, we dachten dat bij stappen nul, een, twee of drie, we zouden aanwijzingen of richtlijnen krijgen, ' zei Piet.
Dat is niet gebeurd. Hij zei dat de onderzoekers erover dachten om op te geven.
"Niets werkte, en het leek alsof onze hypothese helemaal verkeerd was, " hij zei.
"Wat we hebben is dat er niets gebeurt van nul tot één, er gebeurt niets van één tot twee, er gebeurt niets van twee tot drie, er gebeurt niets van drie tot vier, ' zei Peti. 'Als je van vier naar vijf gaat:Boem! Opeens was het er."
Toen al die stappen waren voltooid, hoewel de vorm van p38 niet veranderde, zijn dynamiek deed, zei hij - en die laatste verandering in dynamiek was nodig om het enzym te laten werken.
De volgende stap van het team, Peti zei, is kijken of de beweging van kinasen een rol speelt bij diabetes.
 Geavanceerde kennis en nieuwe technologieën in gashydraatonderzoek
Geavanceerde kennis en nieuwe technologieën in gashydraatonderzoek Planten die in grotten wonen
Planten die in grotten wonen NASA vindt subtropische depressie Albertos-centrum boven Indiana
NASA vindt subtropische depressie Albertos-centrum boven Indiana Wat is de meest overvloedige organische verbinding op aarde?
Wat is de meest overvloedige organische verbinding op aarde?  Professor spoort wetenschappers aan om zich uit te spreken over klimaatverandering
Professor spoort wetenschappers aan om zich uit te spreken over klimaatverandering
Hoofdlijnen
- Team onthult regels voor het maken van ribben
- Hoe Dopamine werkt
- Hoe wordt een bij een bijenkoningin?
- Hoe virtuele geneeskunde werkt
- Vertrouwen op GPS voorkomt dat delen van uw hersenen worden geactiveerd
- Zijn gelukkige mensen aardiger?
- Your Brain On: An All Nighter
- Ontdekking van een mechanisme om de richting van collectieve celmigratie te bepalen
- Nieuwe transdisciplinaire studie onthult microben die op een dag een grote druivenziekte kunnen afschrikken
- Gesmolten geschiedenis op de kaart zetten
- On-the-fly analyse van hoe katalysatoren veranderen tijdens reacties om de prestaties te verbeteren

- Hoe smelt- en kookpunten te berekenen met behulp van molaliteit

- De toevallige ontdekking van een nieuwe groene chemiemethode

- Minder energie nodig om CO2-afval om te zetten in waardevolle hulpbronnen

 Alabama Treasure Hunting
Alabama Treasure Hunting  Nieuwsbericht:nieuwe studie onthult onverwachte zachtheid van dubbellaags grafeen
Nieuwsbericht:nieuwe studie onthult onverwachte zachtheid van dubbellaags grafeen Honda vertraagt Accord, Civic-productie terwijl kopers overschakelen op SUV's
Honda vertraagt Accord, Civic-productie terwijl kopers overschakelen op SUV's Docking, rendez-vous en de derde wet van Newton - de uitdaging om satellieten in de ruimte te onderhouden
Docking, rendez-vous en de derde wet van Newton - de uitdaging om satellieten in de ruimte te onderhouden Amerikaanse waarschuwingen voor zware regen, tornado's van afzwakkende storm Barry
Amerikaanse waarschuwingen voor zware regen, tornado's van afzwakkende storm Barry Italië onthult Romeins mozaïek na eeuwenlange jacht
Italië onthult Romeins mozaïek na eeuwenlange jacht Om een bloeiende cafécultuur in stand te houden, we moeten de wegwerpbeker weggooien.
Om een bloeiende cafécultuur in stand te houden, we moeten de wegwerpbeker weggooien. Zephyr S-drone kan een satellietmededinger zijn als Airbus het uithoudingsrecord vestigt
Zephyr S-drone kan een satellietmededinger zijn als Airbus het uithoudingsrecord vestigt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | French | Spanish |

-
Wetenschap © https://nl.scienceaq.com

