
Wetenschap
Onderzoekers isoleren waterstoffluoride en water om zuuroplossing te begrijpen
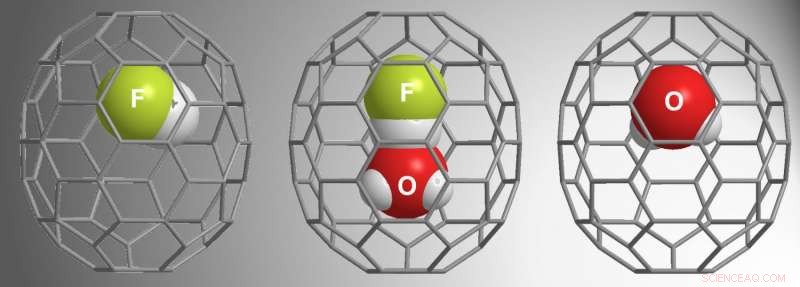
Krediet:Zhang et al.
(Phys.org) — Scheikundelessen op beginnersniveau leren over Brønsted-Lowry-zuren. Deze zuren dissociëren in water om een H . te vormen + ion en een negatief geladen tegenion. Hoewel dit een fundamentele les is, het eigenlijke mechanisme van ontbinding is een beetje een mysterie. De H + molecuul combineert met water om H . te vormen 3 O + , maar het aantal watermoleculen dat nodig is om het eenvoudigste zuur te hydrateren, HF, is onbekend. Pogingen om HF en H . te isoleren 2 o zijn moeilijk, grotendeels vanwege de hoge reactiviteit van HF en de neiging van water om waterstofbruggen te vormen.
Om het fundamentele mechanisme achter zuuroplossing te begrijpen, Zhang et al. van het Instituut voor Chemisch Onderzoek van de Universiteit van Kyoto ingekapseld HF, evenals HF•H 2 O en H 2 O binnen een C 70 fullereen. Ze ontdekten dat om de moleculen in de open fullereenholte te dwingen, de moleculen moesten "van buitenaf worden geduwd" onder hoge druk, en "trekken van binnenuit" via moleculaire interacties tussen HF en H 2 O. Ze waren in staat om te identificeren hoe waterstofbinding plaatsvond tussen deze twee moleculen. Hun werk verschijnt in wetenschappelijke vooruitgang .
Eerder werk van Zhang et al. toonde aan dat de C 70 fullereen kon worden geopend in een driestapsproces waarbij een pyridazinederivaat aan de alfa- of bèta-bindingen op de C werd toegevoegd. 70 . Dit creëerde een 13-delige ringopening die enigszins verschillende verbindingen vormde, aangeduid met α-13mem en β-13mem. Uitdroging van beide verbindingen resulteerde in een 16-ledige ringopening. Via hydrolyse en een tweestapsproces kon de ring weer worden gesloten.
β-16mem was groot genoeg om H . te vangen 2 O, maar α-16mem was dat niet. Gezien deze resultaten uit eerdere onderzoeken, voor de huidige studie, Zhang et al. gebruikte α-16mem om te proberen HF in te kapselen. In plaats daarvan, ze vonden drie verschillende mogelijkheden binnen de fullerenen:HF@C 70 , (HF•H 2 O)@C 70 , en H 2 O@C 70 .
Hun reactieomstandigheden vereisten hoge druk (9000 atm) om het gastmolecuul in de α-16 mem-holte te "duwen". Tijdsafhankelijke studies toonden aan dat HF eerst de holte vulde, gevolgd door H 2 O•HF, en dan H 2 O. Met name, de open kooi heeft H . niet gevangen 2 O wanneer HF niet aanwezig was, wat aangeeft dat de interactie tussen H 2 O en HF vroegen H 2 O inkapseling. Verdere studies toonden aan dat HF H . "trekt" 2 O in de holte terwijl de hogedrukomgeving het in de holte "duwt".
Dit proces stelde de auteurs in staat om de interactie tussen H 2 O en HF in een besloten omgeving met behulp van 1 H NMR. NMR-analyse toonde aan dat de (H 2 O•HF)@C 70 werd teruggeschakeld van H 2 O@C 70 en HF@C 70 , wat wijst op waterstofbinding. Verder, verschuivings- en koppelingswaarden gaven aan dat zuurstof werkte als de waterstofbrugacceptor.
Met behulp van monokristallijne röntgendiffractie, Zhang et al. toonde de structuur van de (HF•H 2 O)@C 70 , en rapporteer de eerste röntgenstructuur voor dubbel ingekapselde C 70 . Deze analyses en experimentele studies bevestigden dat de H + ion in HF vormt een lineaire waterstofbinding met de O in H 2 O. Bovendien, vergeleken met theoretische berekeningen van vrije H 2 O en HF, de studies van de ingekapselde moleculen onthulden nauw contact met waterstof en zuurstof dat kenmerkend kan zijn voor H3O + •F - .
de C 70 fullereenderivaat biedt een uitstekende nano-omgeving voor het bestuderen van geïsoleerde chemische soorten, iets dat in het verleden niet beschikbaar was voor chemici. Deze geïsoleerde omgeving stelde de auteurs in staat om de interacties van twee verbindingen te onderzoeken zonder interferentie van de omgeving en verschafte belangrijke inzichten in een alomtegenwoordig chemisch proces.
© 2017 Fys.org
 Video:U gebruikt desinfectiemiddelen verkeerd. Dit is wat je echt moet doen
Video:U gebruikt desinfectiemiddelen verkeerd. Dit is wat je echt moet doen Chemici hebben de oorsprong van de groene fluorescentie uitgelegd
Chemici hebben de oorsprong van de groene fluorescentie uitgelegd Wetenschappers ontwikkelen elektrochemisch platform voor celvrije synthetische biologie
Wetenschappers ontwikkelen elektrochemisch platform voor celvrije synthetische biologie Nieuwe alternatieven kunnen de vraag naar schaarse permanente magneten van zeldzame aardmetalen verminderen
Nieuwe alternatieven kunnen de vraag naar schaarse permanente magneten van zeldzame aardmetalen verminderen Supercomputing verbetert de conversie van biomassabrandstof
Supercomputing verbetert de conversie van biomassabrandstof
 NASA bereidt zich voor op nieuwe wetenschappelijke vluchten boven de kust van Louisiana
NASA bereidt zich voor op nieuwe wetenschappelijke vluchten boven de kust van Louisiana Onderzoekers modelleren koolstofemissiefluxen in de stedelijke regio van Boston
Onderzoekers modelleren koolstofemissiefluxen in de stedelijke regio van Boston Wat zijn milieuproblemen door bevolkingsgroei?
Wat zijn milieuproblemen door bevolkingsgroei?  NASA vindt windschering nadelig voor Haleh
NASA vindt windschering nadelig voor Haleh Deeltjes van verf, pesticiden kunnen dodelijke gevolgen hebben
Deeltjes van verf, pesticiden kunnen dodelijke gevolgen hebben
Hoofdlijnen
- Wat zijn Twisted DNA-strengen in de kern van het cellichaam?
Desoxyribonucleïnezuur, of DNA, is het materiaal dat door de natuur wordt geselecteerd om de genetische code van de ene generatie van een soort naar de volgende over te brengen. Elke soor
- Wat is sterker:nature of nurture?
- Structuur van het cardiovasculaire systeem
- Ambtenaren:GGO-muggen zijn geen drugs, EPA-toezicht nodig
- Twee soorten fagocyten
- Onderzoeker bespreekt de biologische overspraak tussen microben en gastheren
- Make-up & Science Fair Ideas
- Ontmoet Afrika's vogelmeester van vocale imitatie
- Fotograaf legt menselijk gezicht van bedreigde diersoorten vast
- Biomimetische chemie - DNA-nabootser is viraal enzym te slim af
- Wetenschappers lossen ruwe olie op in water om de samenstelling ervan te bestuderen

- Spinazie:chemie-experimenten tonen potentieel om brandstofcellen van stroom te voorzien

- Goedkope detector is als klittenband voor kankercellen
- Hondenvoer verrukkelijker maken door aroma's te analyseren

 Uitbreiding van de VCSEL-golflengtedekking naar het midden-infrarood
Uitbreiding van de VCSEL-golflengtedekking naar het midden-infrarood U kunt gecodeerde woorden lezen - onder bepaalde omstandigheden
U kunt gecodeerde woorden lezen - onder bepaalde omstandigheden  Tsunamisignalen om afkalven van gletsjers in Groenland te meten
Tsunamisignalen om afkalven van gletsjers in Groenland te meten Hoe het water te berekenen Volume
Hoe het water te berekenen Volume Braziliaanse gemeenschappen bestrijden samen overstromingen – met herinneringen en een app
Braziliaanse gemeenschappen bestrijden samen overstromingen – met herinneringen en een app Het dragen van kleding kan meer microvezels afgeven aan het milieu dan ze te wassen
Het dragen van kleding kan meer microvezels afgeven aan het milieu dan ze te wassen Onderzoekers programmeren RNA-nanodeeltjes die kunnen beschermen tegen Zika
Onderzoekers programmeren RNA-nanodeeltjes die kunnen beschermen tegen Zika Onderzoek toont aan dat vrouwen vaker te maken hebben met meningsverschillen over het schrijven van technische papers
Onderzoek toont aan dat vrouwen vaker te maken hebben met meningsverschillen over het schrijven van technische papers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

