
Wetenschap
Het verwarmen van eiwitten tot lichaamstemperatuur onthult nieuwe medicijndoelen
Sommige eiwitten veranderen van vorm wanneer ze worden blootgesteld aan verschillende temperaturen, waardoor voorheen onbekende bindingsplaatsen voor medicijnen zichtbaar worden, zo blijkt uit nieuw onderzoek.
De bevindingen, gepubliceerd in Nature , zou grote delen van de biologie radicaal kunnen veranderen door de manier waarop de eiwitstructuur wordt bestudeerd en gebruikt voor het ontwerpen van medicijnen fundamenteel te veranderen. De studie werd geleid door Juan Du, Ph.D., en Wei Lü, Ph.D. van het Van Andel Instituut.
Eiwitten worden over het algemeen bij lage temperaturen onderzocht om hun stabiliteit te garanderen. Het nieuwe onderzoek toont echter aan dat bepaalde eiwitten zeer gevoelig zijn voor temperatuur en van vorm veranderen wanneer ze op lichaamstemperatuur worden bekeken.
"De methoden die we hebben gebruikt om eiwitten te bestuderen vereisen lange tijd dat ze koud of bevroren zijn, maar in de echte wereld bestaan menselijke eiwitten en functioneren ze op lichaamstemperatuur", zei Du. "Onze studie beschrijft een nieuwe manier om eiwitten bij lichaamstemperatuur te bestuderen en laat zien dat sommige eiwitten hun structuur drastisch veranderen als ze warm zijn, wat nieuwe mogelijkheden opent voor structuurgestuurde ontwikkeling van geneesmiddelen."
Eiwitten zijn de moleculaire werkpaarden van het lichaam. Hun vorm bepaalt hoe ze omgaan met andere moleculen om hun werk te doen. Door de eiwitstructuur te bepalen, kunnen wetenschappers blauwdrukken maken die de ontwikkeling van effectievere medicijnen begeleiden, net zoals slotenmakers sleutels ontwerpen die in specifieke sloten passen.
Hoewel het algemeen bekend is dat temperatuur de moleculaire functie in het lichaam beïnvloedt, is het bestuderen van eiwitten bij fysiologische temperatuur een technologische uitdaging. Het onderzoek van de Du- en Lü-laboratoria beschrijft hoe zij deze problemen hebben overwonnen en biedt wetenschappers een routekaart om dit in hun eigen experimenten te doen.
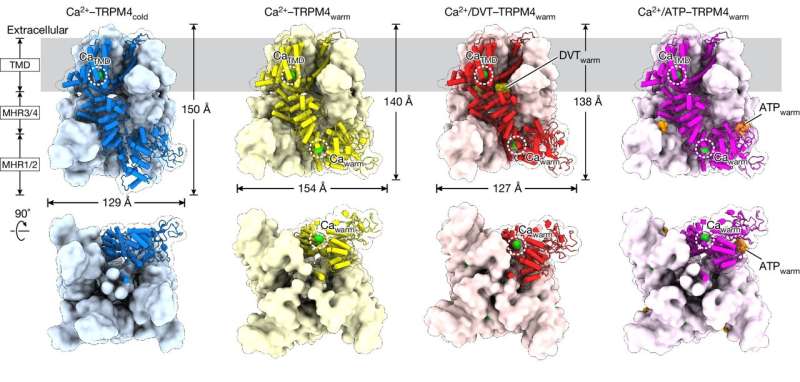
De studie concentreerde zich op een eiwit genaamd TRPM4, dat de hartfunctie en het metabolisme ondersteunt, inclusief de afgifte van insuline. Als zodanig is TRPM4 gekoppeld aan beroertes, hartziekten en diabetes, naast andere gezondheidsproblemen.
Om TRPM4 op lichaamstemperatuur te visualiseren, maakte het team gebruik van VAI's krachtige reeks cryo-elektronenmicroscopen (cryo-EM), waarmee wetenschappers eiwitten snel kunnen invriezen en gedetailleerde beelden van hun structuren kunnen samenstellen. In plaats van een monster op lage temperatuur te gebruiken, verwarmden postdoctoraal collega Jinhong Hu, Ph.D., en collega's in de Du- en Lü-laboratoria het monster tot lichaamstemperatuur voordat het snel invroor. Door dit te doen ontdekten ze dat liganden (moleculen die zich aan eiwitten binden) bij lichaamstemperatuur met totaal andere plaatsen op TRPM4 interageren dan bij lagere temperaturen.
De implicaties van het huidige onderzoek zijn verreikend en versterken het belang van het bestuderen van eiwitten bij lichaamstemperatuur om de identificatie van fysiologisch relevante geneesmiddelbindingsplaatsen te garanderen.
Andere auteurs zijn onder meer Sung Jin Park, Ph.D., Tyler Walter, Ph.D., Ian J. Orozco, Ph.D., Garrett O'Dea en Xinyu Ye van VAI. De cryo-EM-gegevens werden verzameld in VAI's Cryo-EM Core en David Van Andel Cryo-Electron Microscopy Suite.