
Wetenschap
Nieuw onderzoek heeft uitgewezen dat virussen ogen en oren op ons kunnen richten
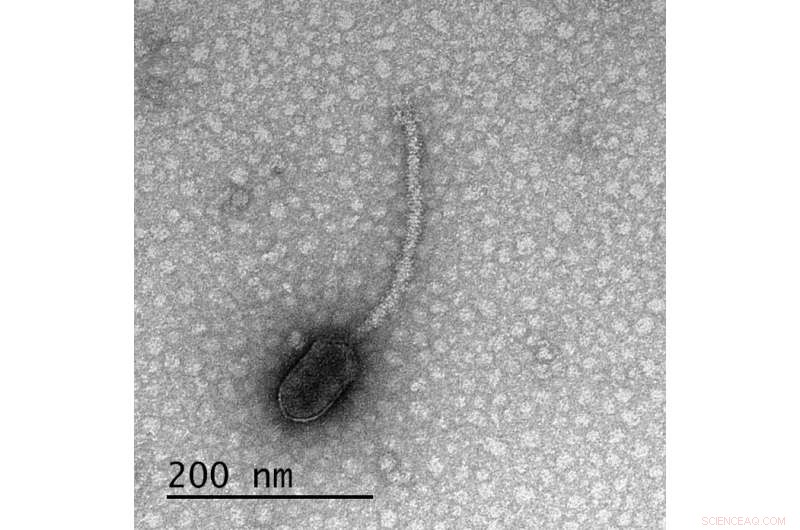
Een delta-bacteriofaag, de eerste geïdentificeerd in een nieuwe studie in Frontiers in Microbiology bindingsplaatsen hebben voor CtrA, een eiwit geproduceerd door de gastheer van de bacteriofaag dat de productie van pili en flagella reguleert. De aanwezigheid van deze bindingsplaatsen alleen in fagen die vereisen dat hun gastheercellen pili/flagella hebben om ze te infecteren, suggereert dat de faag de aanwezigheid van dit eiwit volgt om te "beslissen" of ze blijven zitten of repliceren en tevoorschijn komen uit zijn gastheercel. Krediet:Tagide deCarvalho/UMBC
Nieuw door UMBC geleid onderzoek in Frontiers in Microbiology suggereert dat virussen informatie uit hun omgeving gebruiken om te "beslissen" wanneer ze in hun gastheer moeten blijven zitten en wanneer ze zich moeten vermenigvuldigen en uitbarsten, waarbij de gastheercel wordt gedood. Het werk heeft gevolgen voor de ontwikkeling van antivirale geneesmiddelen.
Het vermogen van een virus om zijn omgeving waar te nemen, inclusief elementen die door zijn gastheer worden geproduceerd, voegt "een extra laag complexiteit toe aan de interactie tussen de gastheer en het virus", zegt Ivan Erill, hoogleraar biologische wetenschappen en senior auteur van het nieuwe artikel. Op dit moment exploiteren virussen dat vermogen in hun voordeel. Maar in de toekomst, zegt hij, "kunnen we het in hun nadeel uitbuiten."
Geen toeval
De nieuwe studie richtte zich op bacteriofagen - virussen die bacteriën infecteren, vaak eenvoudigweg 'fagen' genoemd. De fagen in het onderzoek kunnen hun gastheren alleen infecteren als de bacteriecellen speciale aanhangsels hebben, pili en flagella genaamd, die de bacteriën helpen bewegen en paren. De bacteriën produceren een eiwit genaamd CtrA dat bepaalt wanneer ze deze aanhangsels genereren. Het nieuwe artikel laat zien dat veel aanhangselafhankelijke fagen patronen in hun DNA hebben waar het CtrA-eiwit zich kan hechten, bindingsplaatsen genoemd. Een faag met een bindingsplaats voor een eiwit dat door zijn gastheer wordt geproduceerd, is ongebruikelijk, zegt Erill.
Nog verrassender is dat Erill en de eerste auteur van het artikel, Elia Mascolo, een Ph.D. student in het laboratorium van Erill, ontdekte door gedetailleerde genomische analyse dat deze bindingsplaatsen niet uniek waren voor een enkele faag, of zelfs een enkele groep fagen. Veel verschillende soorten fagen hadden CtrA-bindingsplaatsen, maar ze hadden allemaal hun gastheer nodig om pili en/of flagella te hebben om ze te infecteren. Het kon geen toeval zijn, besloten ze.
De mogelijkheid om CtrA-niveaus te controleren "is tijdens de evolutie meerdere keren uitgevonden door verschillende fagen die verschillende bacteriën infecteren", zegt Erill. Wanneer verre verwante soorten een vergelijkbare eigenschap vertonen, wordt dit convergente evolutie genoemd - en het geeft aan dat de eigenschap zeker nuttig is.
Timing is alles
Nog een rimpel in het verhaal:de eerste faag waarin het onderzoeksteam CtrA-bindingsplaatsen identificeerde, infecteert een bepaalde groep bacteriën genaamd Caulobacterales. Caulobacterales zijn een bijzonder goed bestudeerde groep bacteriën, omdat ze in twee vormen bestaan:een "zwermvorm" die vrij rondzwemt, en een "gestalkte" vorm die zich hecht aan een oppervlak. De zwermers hebben pili/flagella en de stelen niet. In deze bacteriën reguleert CtrA ook de celcyclus, waarbij wordt bepaald of een cel zich gelijkmatig in twee meer van hetzelfde celtype zal verdelen, of zich asymmetrisch zal delen om één zwermcel en één stengelcel te produceren.
Omdat de fagen alleen zwermcellen kunnen infecteren, is het in hun eigen belang alleen uit hun gastheer te barsten als er veel zwermcellen beschikbaar zijn om te infecteren. Over het algemeen leven Caulobacterales in voedselarme omgevingen en zijn ze erg verspreid. "Maar wanneer ze een goede microhabitat vinden, worden ze gestalkte cellen en vermenigvuldigen ze zich", zegt Erill, en produceert uiteindelijk grote hoeveelheden zwermcellen.
Dus:"We veronderstellen dat de fagen de CtrA-niveaus bewaken, die tijdens de levenscyclus van de cellen op en neer gaan, om erachter te komen wanneer de zwermcel een stengelcel wordt en een fabriek van zwermers wordt," zegt Erill, "en op dat moment barsten ze de cel open, omdat er veel zwervers in de buurt zullen zijn om te infecteren."
Luisteren
Helaas is de methode om deze hypothese te bewijzen arbeidsintensief en extreem moeilijk, dus dat maakte geen deel uit van dit laatste artikel, hoewel Erill en collega's die vraag in de toekomst hopen aan te pakken. Het onderzoeksteam ziet echter geen andere plausibele verklaring voor de proliferatie van CtrA-bindingsplaatsen op zoveel verschillende fagen, die allemaal pili/flagella nodig hebben om hun gastheren te infecteren. Nog interessanter, merken ze op, zijn de implicaties voor virussen die andere organismen infecteren, zelfs mensen.
"Alles wat we weten over fagen, elke evolutionaire strategie die ze hebben ontwikkeld, blijkt te vertalen naar virussen die planten en dieren infecteren", zegt hij. "Het is bijna een gegeven. Dus als fagen luisteren naar hun gastheren, zullen de virussen die mensen beïnvloeden ongetwijfeld hetzelfde doen."
Er zijn een paar andere gedocumenteerde voorbeelden van fagen die hun omgeving op interessante manieren bewaken, maar geen enkele bevat zoveel verschillende fagen die dezelfde strategie toepassen tegen zoveel bacteriële gastheren.
Dit nieuwe onderzoek is de "eerste grootschalige demonstratie dat fagen luisteren naar wat er in de cel gebeurt, in dit geval in termen van celontwikkeling", zegt Erill. Maar er komen nog meer voorbeelden aan, voorspelt hij. Leden van zijn laboratorium zijn al op zoek gegaan naar receptoren voor andere bacteriële regulerende moleculen in fagen, zegt hij, en ze vinden ze.
Nieuwe therapeutische wegen
De belangrijkste conclusie van dit onderzoek is dat "het virus cellulaire informatie gebruikt om beslissingen te nemen", zegt Erill, "en als het bij bacteriën gebeurt, gebeurt het vrijwel zeker bij planten en dieren, want als het een evolutionaire strategie is die logisch is, evolutie zal het ontdekken en exploiteren."
Om bijvoorbeeld zijn overlevings- en replicatiestrategie te optimaliseren, wil een dierlijk virus misschien weten in wat voor soort weefsel het zit, of hoe robuust de immuunrespons van de gastheer op zijn infectie is. Hoewel het misschien verontrustend is om na te denken over alle informatie die virussen kunnen verzamelen en mogelijk gebruiken om ons zieker te maken, openen deze ontdekkingen ook wegen voor nieuwe therapieën.
"Als je een antiviraal medicijn ontwikkelt en je weet dat het virus naar een bepaald signaal luistert, dan kun je het virus misschien voor de gek houden", zegt Erill. Dat is echter een paar stappen verwijderd. Voor nu:"We beginnen ons net te realiseren hoe actief virussen ons in de gaten houden - hoe ze in de gaten houden wat er om hen heen gebeurt en op basis daarvan beslissingen nemen", zegt Erill. "Het is fascinerend." + Verder verkennen
Sommige microben liggen op de loer totdat hun gastheren hen onbewust het signaal geven om zich te gaan vermenigvuldigen en ze te doden
 Onderzoekers ontdekken SARS-CoV-2-remmers
Onderzoekers ontdekken SARS-CoV-2-remmers Papierspoor leidt tot ontdekkingen van hartkleppen
Papierspoor leidt tot ontdekkingen van hartkleppen Wetenschappers ontwikkelen stereogedefinieerde N- en S-atoom-gecodeerde graphdiyne voor zuurstofevolutie
Wetenschappers ontwikkelen stereogedefinieerde N- en S-atoom-gecodeerde graphdiyne voor zuurstofevolutie COVID-19 testmethode geeft binnen één seconde resultaat
COVID-19 testmethode geeft binnen één seconde resultaat Nieuwe vloeistofmodelleringstechniek voorspelt chemische reacties en verlaagt de ontwikkelingskosten van geneesmiddelen
Nieuwe vloeistofmodelleringstechniek voorspelt chemische reacties en verlaagt de ontwikkelingskosten van geneesmiddelen
 Het opladen van bodems met koolstof kan boerderijen productiever maken
Het opladen van bodems met koolstof kan boerderijen productiever maken Vulkaan Papoea-Nieuw-Guinea barst uit waardoor bewoners op de vlucht slaan
Vulkaan Papoea-Nieuw-Guinea barst uit waardoor bewoners op de vlucht slaan Groot-Brittannië zou zijn eerste volledige dag zonder kolen kunnen zien
Groot-Brittannië zou zijn eerste volledige dag zonder kolen kunnen zien De lengte van een alligator schatten met zijn kopgrootte
De lengte van een alligator schatten met zijn kopgrootte NASA staart in tropische storm Lekima in Filippijnse Zee
NASA staart in tropische storm Lekima in Filippijnse Zee
Hoofdlijnen
- Hoe licht en temperatuur samenwerken om de plantengroei te beïnvloeden
- Waarom is fotosynthese belangrijk voor mensen?
- Wat breekt een dubbele helix van DNA af?
- Wat is een tetrad in de microbiologie?
- Mysterie van uitgestorven Nieuw-Zeelandse vissen ontrafeld
- Moderne mensen genereren meer hersenneuronen dan Neanderthalers
- Wat zijn de functies van een levercel?
- Vingerafdrukexperimenten
- Een model van een cel-kern maken
- Onderzoek levert test op om bittere pitstoornis in Honeycrisp-appels te voorspellen

- Top 10 ziektekiemen op uw smartphone

- In de mangoestenmaatschappij immigranten zijn een bonus - als ze tijd krijgen om zich te vestigen

- Moleculaire mechanismen van paaigewoonten voor adaptieve straling van endemische Oost-Aziatische karperachtigen

- Het zien van voedsel kan vissen naar het land hebben gelokt

 Zending ruimtestation gelanceerd vanaf de kust van Virginia
Zending ruimtestation gelanceerd vanaf de kust van Virginia Tv-advertenties wekken investeringsinteresse, studie vondsten
Tv-advertenties wekken investeringsinteresse, studie vondsten Model voorspelt wanneer rivieren die breuken kruisen van koers veranderen
Model voorspelt wanneer rivieren die breuken kruisen van koers veranderen Het herbestemmen van ruimtes die leeg zijn gelaten door COVID-19 kan steden nieuw leven inblazen, zegt onderzoeker
Het herbestemmen van ruimtes die leeg zijn gelaten door COVID-19 kan steden nieuw leven inblazen, zegt onderzoeker De discrete-tijd-fysica die zich verbergt in onze continu-tijdwereld
De discrete-tijd-fysica die zich verbergt in onze continu-tijdwereld Op weg naar in massa produceerbare kwantumcomputers
Op weg naar in massa produceerbare kwantumcomputers Nieuwe inzichten over gevangen elektronen kunnen het flashgeheugen verbeteren
Nieuwe inzichten over gevangen elektronen kunnen het flashgeheugen verbeteren Hoeveel kost het om met dolfijnen te zwemmen?
Hoeveel kost het om met dolfijnen te zwemmen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

