
Wetenschap
Hoe superbacteriën spiegelbeelden gebruiken om antibioticaresistentie te creëren
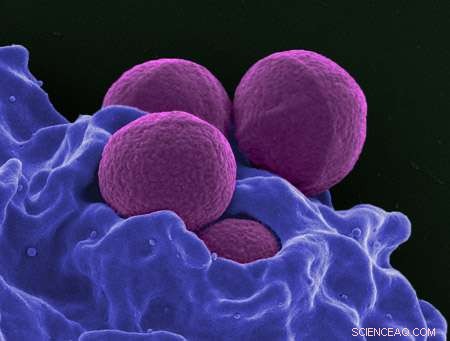
Een ingekleurde scanning-elektronenmicrofoto van MRSA. Krediet:Nationaal Instituut voor Allergie en Infectieziekten
Methicilline-resistente Staphylococcus aureus (MRSA) is een bacteriële infectie die resistent is geworden tegen de meeste antibiotica die worden gebruikt om reguliere stafylokokbesmettingen te behandelen. Duke University computerwetenschapper Bruce Donald en medewerkers van de University of Connecticut werken aan de ontwikkeling van nieuwe enzymremmers om MRSA te bestrijden. In onderzoek gepubliceerd in PLOS Computational Biology , ontdekte het team hoe een enkele kleine mutatie een groot verschil maakt in de werkzaamheid van geneesmiddelen.
Ze onderzochten dihydrofolaatreductase (DHFR), een enzym dat antibiotica gebruiken om MRSA te bestrijden. Geneesmiddelen die DHFR remmen, werken een beetje zoals sloten en sleutels; ze binden aan enzymen in MRSA, die een specifieke driedimensionale structuur hebben waardoor alleen moleculen die precies passen zich eraan kunnen hechten.
Een mutatie kan de structuur van een bacterieel enzym veranderen en ervoor zorgen dat medicijnen hun effectiviteit verliezen. De F98Y-mutatie is een bekende resistentiemutatie. Een kleine verandering in het 98e aminozuur in het DHFR-enzym verandert een fenylalanine in een tyrosine. "Die twee aminozuren lijken qua structuur op elkaar", zegt Graham Holt, afgestudeerde student in het Donald-lab, "maar de mutatie heeft een enorm effect op de werkzaamheid van de remmers." In wezen verandert het het slot.
Pablo Gainza, Ph.D., voormalig afgestudeerde student in het Donald-lab, dacht dat hij deze mutatie zou moeten kunnen voorspellen met behulp van OSPREY, een reeks programma's voor op computerstructuren gebaseerd eiwitontwerp ontwikkeld in het Donald-lab. Maar dat kon hij niet. Nadat hij hypothese na hypothese had verworpen om erachter te komen waarom hij deze mutatie niet kon voorspellen, ging hij terug om de startstructuur te onderzoeken.
"We keken naar de elektronendichtheidsgegevens van de kristallograaf en vonden iets vreemds," zei Donald. Bij het proberen de structuur van de F98Y-mutant te bepalen, gebruikten kristallografen een computerprogramma dat - buiten het medeweten van hen - de chiraliteit omdraaide, of een spiegelbeeld maakte, van de NADPH-cofactor om een betere pasvorm te krijgen. De "omgedraaide" chemische soort die ze tijdens hun analyse ontdekten, bestaat in experimentele omstandigheden in het laboratorium en aannemelijk in vivo.
"Met behulp van OSPREY ontdekten we deze omgedraaide chiraliteit," zei Donald, "waarvan we denken dat dit gebeurde vanwege de F98Y-mutatie." Net als bij 2-factorauthenticatie lijken de enkele enzymmutatie en de omgedraaide cofactor samen te spannen om de remmer te ontwijken.
Deze "chirale ontduiking" verandert de structurele basis voor weerstand. Maar nu weten Donald en collega's niet alleen hoe een enkele kleine mutatie het slot heeft veranderd, maar ook de structuur die ze nodig hebben om een betere sleutel te maken - een betere medicijnremmer.
"Dit is het eerste voorbeeld van een enzym dat de chiraliteit van zijn cofactor uitbuit om zijn remmers te ontwijken," zei Holt. "Nu we dit zien gebeuren, zal dat helpen bij het informeren van computationele strategieën om betere remmers te ontwikkelen."
Het Donald-lab toonde aan dat de voorspellingen van OSPREY, door rekening te houden met omgedraaide chiraliteit, nauw overeenkomen met experimentele metingen van de remmingskracht. Ze werkten samen met medewerkers van de Universiteit van Connecticut die biochemische experimenten uitvoerden om de theorie te testen en structureel bewijs te leveren.
'Dit is nog maar het begin van het verhaal,' zei Donald. "Onze ontdekking van chirale ontduiking zou moeten leiden tot veerkrachtiger remmers:betere medicijnontwerpen." Op dit moment is het meeste medicijnontwerp reactief, wachtend op het ontstaan van resistentie, wat altijd het geval is. "We hopen het medicijnontwerp proactief te maken door onze algoritmen te gebruiken om op resistentie te anticiperen," zei Donald.
 Antimicrobieel natuurlijk product actief tegen zowel MRSA als malaria veroorzakende parasiet
Antimicrobieel natuurlijk product actief tegen zowel MRSA als malaria veroorzakende parasiet Nieuw covalent organisch raamwerk met boor en fosfor zorgt voor betere connectiviteit
Nieuw covalent organisch raamwerk met boor en fosfor zorgt voor betere connectiviteit Berekenen RRT
Berekenen RRT Materiaal voor nieuwe generatie atoomreactoren ontwikkeld
Materiaal voor nieuwe generatie atoomreactoren ontwikkeld Met een meerlagige aanpak, een filter om te voldoen aan de behoeften van de zoetwatervoorziening
Met een meerlagige aanpak, een filter om te voldoen aan de behoeften van de zoetwatervoorziening
 Omgord door zee, Australië staat voor serieuze klimaatuitdaging
Omgord door zee, Australië staat voor serieuze klimaatuitdaging Steden werpen schaduw bij stijgende hitte
Steden werpen schaduw bij stijgende hitte Het verschil tussen Wespen en Bees
Het verschil tussen Wespen en Bees bijna 200, 000 mensen worden elke dag blootgesteld aan vulkanische gevarenzones in Californië, rapport zegt
bijna 200, 000 mensen worden elke dag blootgesteld aan vulkanische gevarenzones in Californië, rapport zegt Snelle bodemtest is bedoeld om stikstofbehoefte te bepalen
Snelle bodemtest is bedoeld om stikstofbehoefte te bepalen
Hoofdlijnen
- Welk einde is typisch te vinden aan het einde van de enzymnamen?
- Het geheim van betere koffie? De vogels en de bijen
- Een JELL-O-model van een diercel maken
- Eencellige tools geven inzicht in actieve antibioticaresistentie in bodems
- Wetenschappers maken apparaat voor ultranauwkeurige genoomsequencing van afzonderlijke menselijke cellen
- Thailand verbergt grote aantallen als het gaat om zijn visvangsten in aangrenzende wateren
- Controversiële onkruidverdelger houdt EU in de knoop (Update)
- Landbouwfungicide trekt honingbijen aan, studie vondsten
- Kaketoes die bakken openen, gaan de wapenwedloop met mensen aan
- Genetici ontdekken nieuwe ondersoorten van wilde geiten via oud DNA

- Onderzoekers ontdekken een nieuwe manier om door virussen veroorzaakte kankers te onderdrukken

- Jagen op ooien met dikhoornschapen zou meer trofeerammen kunnen opleveren

- Spiegelbeeldmoleculen onthullen droogtestress in bossen

- Dichte vloeistofdruppels fungeren als mobiele computers

 Kleine ijsverliezen aan de randen van Antarctica kunnen het ijsverlies ver weg versnellen
Kleine ijsverliezen aan de randen van Antarctica kunnen het ijsverlies ver weg versnellen Booms &busts:hoe de jaren tachtig de grote recessie hadden kunnen voorspellen
Booms &busts:hoe de jaren tachtig de grote recessie hadden kunnen voorspellen Massaal hout:groot denken over duurzaam bouwen
Massaal hout:groot denken over duurzaam bouwen Hoe Kva naar Amp
Hoe Kva naar Amp Je bent op vakantie en je hebt geen telefoonopslag meer - wat te doen?
Je bent op vakantie en je hebt geen telefoonopslag meer - wat te doen? Bronnen van water in het oude Mesopotamië
Bronnen van water in het oude Mesopotamië
Er verandert veel met het verstrijken van de tijd, vooral wanneer het duizenden jaren betreft. Wat echter onveranderd blijft, is de status van water als de meest vitale voedingsstof voor de mens. De mensen
 Feiten over witte eiken bomen
Feiten over witte eiken bomen  Telefoons en wearables worden gecombineerd om de prestaties van werknemers te beoordelen
Telefoons en wearables worden gecombineerd om de prestaties van werknemers te beoordelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

