
Wetenschap
Hoe een molecuul met twee gezichten problematische genen tot zwijgen kan brengen
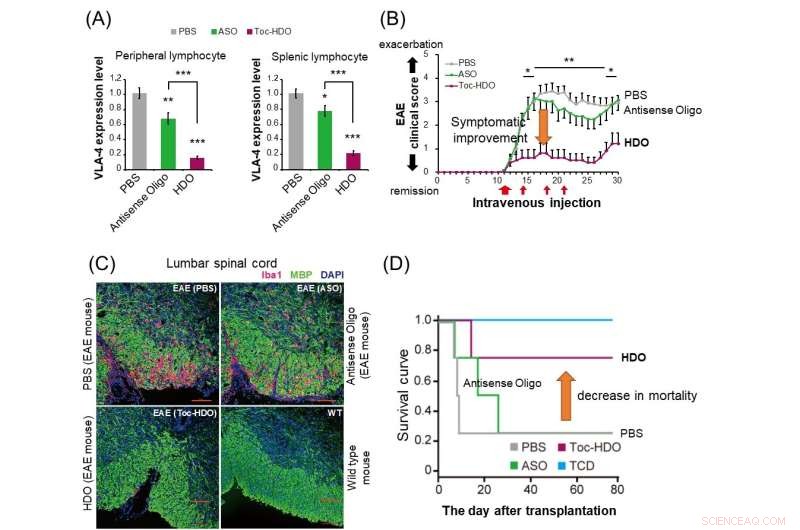
(A) Bij normale muizen onderdrukt de toediening van HDO (rode balk) de α4β1-integrine-genexpressie in perifere en miltlymfocyten drastischer in vergelijking met antisense-oligonucleotide (groene balk). (B) Bij experimentele muizen met auto-immuun encefalomyelitis (EAE) heeft toediening van HDO gericht op α4β1-integrine na het begin van de symptomen een verbetering van de klinische score laten zien. (C) Toediening van HDO gericht op α4β1-integrine voorafgaand aan het begin van EAE-muizen resulteert in verminderde Iba1-positieve infiltratie van ontstekingscellen (rood) en verbeterde demyelinisatie (groen) in het lumbale ruggenmerg. (D) In het muismodel van graft-versus -gastheerziekte (GVHD), transplantatie van milt-afgeleide T-cellen samen met beenmergcellen na behandeling met HDO gericht op α4β1-integrine verbeterde de overlevingscurve. TCD:Getransplanteerde beenmergcellen zonder milt-afgeleide T-cellen. Credit:Afdeling Neurologie en Neurologische Wetenschappen, TMDU
T- en B-lymfocyten, die deel uitmaken van een groep immuuncellen die gewoonlijk witte bloedcellen worden genoemd, werken samen om vreemde indringers in het lichaam, zoals virussen, te elimineren. Bepaalde ziekten kunnen echter ontstaan wanneer T- en B-cellen op ongepaste tijdstippen worden geactiveerd, waaronder auto-immuunziekten en verschillende vormen van kanker. In een recent artikel gepubliceerd in Nature Communications , beschrijft een team onder leiding van onderzoekers van de Tokyo Medical and Dental University (TMDU) een technologie genaamd heteroduplex oligonucleotide (HDO) die ze hebben ontwikkeld om aan lymfocyten te leveren en hun functies te reguleren.
Genexpressie ligt aan de basis van het beheersen van cellulaire activiteit. Ziekte kan ontstaan wanneer bepaalde genen ofwel onjuist zijn uitgeschakeld of ongecontroleerd tot expressie worden gebracht. Daarom hebben wetenschappers ernaar gestreefd therapeutische methoden te ontwikkelen om genexpressieniveaus te herstellen naar hun gezonde toestand, idealiter alleen in de abnormale cellen. Eén zo'n modaliteit is het afleveren van specifiek gemanipuleerde DNA- of RNA-moleculen die de verkeerd tot expressie gebrachte genberichten kunnen lokaliseren en de cel kunnen sturen om ze terug te brengen naar normale niveaus. Het moeilijkste hiervan is echter om ervoor te zorgen dat de therapeutische moleculen efficiënt hun juiste bestemming kunnen bereiken zonder door de cel te worden afgebroken.
"Ons team ontwierp een hybride DNA/RNA-molecuul, een HDO genaamd", zegt hoofdauteur van de studie Masaki Ohyagi. "De specifieke sequentie van de HDO kan worden gewijzigd om een bepaald gen van belang te targeten, terwijl de ruggengraat het stabiel maakt in cellen."
Een belangrijk onderdeel van het HDO-ontwerp van het team is de toevoeging van een molecuul genaamd α-tocoferol, dat cruciaal is voor de juiste afgifte ervan. Omdat α-tocoferol essentieel is voor een goede lymfatische immuunrespons, kan door toevoeging hiervan de HDO in perifeer bloed worden afgeleverd en naar lymfocyten worden geleid. Het team ontwierp HDO's voor verschillende muizengenen en injecteerde ze vervolgens intraveneus in laboratoriummuizen.
"We ontdekten dat onze HDO-technologie in staat was om deze genen in muislymfocyten robuuster en stabieler, en ook met minder toxiciteit, specifiek tot zwijgen te brengen dan andere eerdere versies van deze methode", zegt Takanori Yokota, senior auteur van het artikel. "Onze studies toonden ook aan dat de HDO's deze cellen binnendringen via een proces dat endocytose wordt genoemd."
Nadat ze hadden ontdekt dat hun technologie effectief was bij het uitschakelen van genen, onderzocht het TMDU-team of het nuttig zou kunnen zijn als een ziektebehandeling. Ze ontwierpen een HDO gericht op een gen genaamd Itga4, dat centraal staat in de pathogenese van experimentele auto-immuun encefalomyelitis (EAE), een muismodel voor multiple sclerose (MS).
"Het intraveneus injecteren van deze muizen met een Itga4-targeting HDO vertraagde het begin en verbeterde EAE-symptomen en verminderde zowel infiltratie van ontstekingscellen als demyelinisatie van het ruggenmerg", legt Ohyagi uit.
Dit werk demonstreert de krachtige genuitschakelingseffecten van de HDO-technologie, evenals de superieure leveringsmogelijkheden in vergelijking met andere vergelijkbare methoden. Het belangrijkste was dat de Itga4-specifieke HDO de resultaten in een MS-muismodel kon verbeteren, wat suggereert dat het nuttig kan zijn als een nieuw therapeutisch middel dat kan worden ontwikkeld voor menselijke immuungemedieerde ziekten.
 Zeer gevoelige methode om potentiële kankerbiomarker te detecteren
Zeer gevoelige methode om potentiële kankerbiomarker te detecteren Wetenschappers ontwerpen snel, omkeerbare bio-geïnspireerde katalysatoren
Wetenschappers ontwerpen snel, omkeerbare bio-geïnspireerde katalysatoren Op hout gebaseerde vezels vangen hormonen uit afvalwater
Op hout gebaseerde vezels vangen hormonen uit afvalwater Zelfassemblerende homo-oligomeren van cyclische eiwitten
Zelfassemblerende homo-oligomeren van cyclische eiwitten Leren van de rijkdom van de natuur:nieuwe bibliotheken voor het ontdekken van medicijnen
Leren van de rijkdom van de natuur:nieuwe bibliotheken voor het ontdekken van medicijnen
 Veel aanrijdingen tussen dieren en voertuigen te voorkomen
Veel aanrijdingen tussen dieren en voertuigen te voorkomen Nieuwe geologische modelleringsmethode verklaart ineenstorting van oude bergen in het Amerikaanse Westen
Nieuwe geologische modelleringsmethode verklaart ineenstorting van oude bergen in het Amerikaanse Westen Waarom sommige orkanen aanhouden terwijl andere stormen snel sterven
Waarom sommige orkanen aanhouden terwijl andere stormen snel sterven Wat gebeurt er als zeestromingen stoppen?
Wat gebeurt er als zeestromingen stoppen?  Het onderwaterwonderland van Boedapest trekt duikers van heinde en verre
Het onderwaterwonderland van Boedapest trekt duikers van heinde en verre
Hoofdlijnen
- Het verschil tussen gensequentie en DNA-vingerafdrukken
- Stamcelplatform werpt nieuw licht op het begin van menselijke ontwikkeling
- Hoe werkt ADP naar ATP?
- Wat guppy-lef ons kan leren over evolutie
- Waarom planten wereldwijd houtachtig werden
- Hoe robots de productiecrisis van antibiotica kunnen oplossen
- Studie analyseert de eigenaardige schedelanatomie van brulapen
- Voorspellen wat uitsterven kan betekenen voor lemuren en de bossen die ze thuis noemen
- We kregen te maken met misbruik omdat we mensen vroegen om wespen te doden voor de wetenschap - hier is waarom het de moeite waard was
- Big data helpt onderzoekers in de strijd om plantenindringers onder controle te krijgen

- Menselijke blastoïden bieden medische hoop, maar ook diepe ethische uitdagingen

- Nieuw onderzoek volgt de geschiedenis van zeekoeien over de oceanen van de aarde

- Eiwit beperkt de opname van sap door bladluizen

- Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierencel?

 Hoe het decimale nummer van Dewey voor een boek te vinden
Hoe het decimale nummer van Dewey voor een boek te vinden  Grootschalig experiment op het landelijke Olympisch schiereiland om innovaties in bosbeheer te testen
Grootschalig experiment op het landelijke Olympisch schiereiland om innovaties in bosbeheer te testen NASA ziet tropische cycloon koken sterk getroffen door windschering
NASA ziet tropische cycloon koken sterk getroffen door windschering Metaalvrij MRI-contrastmiddel kan voor sommige patiënten veiliger zijn
Metaalvrij MRI-contrastmiddel kan voor sommige patiënten veiliger zijn Gesprekken tussen SAS en piloten worden hervat naarmate meer vluchten worden geannuleerd
Gesprekken tussen SAS en piloten worden hervat naarmate meer vluchten worden geannuleerd Zal de overstap naar de commerciële cloud sommige datagebruikers achterlaten?
Zal de overstap naar de commerciële cloud sommige datagebruikers achterlaten? Optische stofzuiger kan nanodeeltjes manipuleren
Optische stofzuiger kan nanodeeltjes manipuleren De Euclid-ruimtetelescoop komt samen
De Euclid-ruimtetelescoop komt samen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

