
Wetenschap
Zelfassemblerende homo-oligomeren van cyclische eiwitten
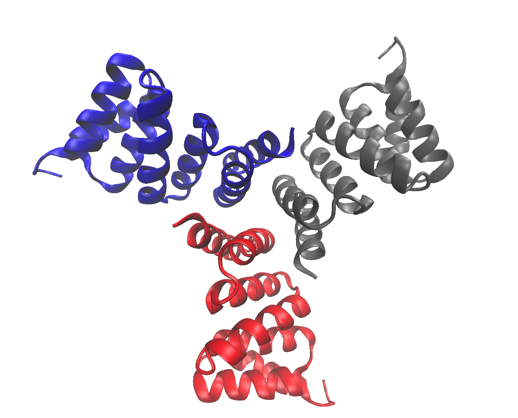
De kristalstructuur met hoge resolutie van een van de bestudeerde eiwitten, een computationeel ontworpen trimeer. De structuur is gedeponeerd in de Protein Data Bank met toegangsnummer 5HRZ. Krediet:Lawrence Berkeley National Laboratory
Cyclische eiwitten die zijn samengesteld uit meerdere identieke subeenheden (homo-oligomeren) spelen een sleutelrol in veel biologische processen, inclusief celsignalering en enzymatische katalyse en eiwitfunctie. Onderzoekers van de afdeling Molecular Biophysics and Integrated Bioimaging (MBIB) van Berkeley Lab werkten samen met David Baker van de University of Washington, die een team leidde om in silico te ontwerpen en zelfassemblerende cyclische homo-oligomeer-eiwitten te kristalliseren.
Door deze hogere-orde oligomeren te voorspellen en te ontwerpen, Baker en zijn team hebben inzicht gekregen in de fundamentele principes die ten grondslag liggen aan oligomeer-oligomeer-interacties. Naast de interne interacties van het eiwit zelf, deze ontworpen oligomeren kunnen worden gebruikt om fundamentele vragen te onderzoeken over hoe de structuur van signaalmoleculen het gedrag van receptoren en cellulaire respons beïnvloedt.
Er werd een strategie ontwikkeld om interfaces op geïdealiseerde eiwitten te ontwerpen die erop gericht zijn hun assemblage in multimere complexen te leiden. Onderzoekers van Berkeley Lab gebruikten structurele karakterisering - zowel röntgenkristallografie als kleine hoek röntgenverstrooiing (SAXS) - om aan te tonen dat veel van de ontwerpen de doeloligomerisatietoestand en voorspelde structuur overnamen. Hun werk toont niet alleen aan dat wetenschappers een basiskennis hebben van wat oligomerisatie bepaalt, het laat ook zien dat ze eiwitten kunnen ontwerpen met een afstembare vorm, maat, en symmetrie voor een verscheidenheid aan biologische toepassingen.
Een deel van het röntgenkristallografiewerk dat in het artikel is opgenomen, werd uitgevoerd onder auspiciën van het Crystallography Collective-programma, die wordt gerund door onderzoekswetenschapper Banumathi Sankaran bij de Advanced Light Source. Collega-onderzoeker Henrique Pereira kristalliseerde de eiwitten die zijn ontworpen door de onderzoekers van de Universiteit van Washington. Sankaran en Peter Zwart, MBIB stafwetenschapper, verzamelde kristallografische gegevens op Beamline 5.0.2 in het Berkeley Center for Structural Biology en loste de structuren op. Om informatie te krijgen over de ontworpen eiwitdynamiek, Kathryn Burnett en Greg Hura van MBIB voerden SAXS uit op de SIBYLS-bundellijn.
Pereira, Sankaran, en Zwart zijn co-auteurs van verschillende artikelen met Baker en zijn team, die allemaal een thema volgen van eiwitontwerp en structuurvalidatie.
"Cyclische homo-oligomeren spelen een belangrijke rol in de biologische functie, " zei Sankaran. "Hier hebben we nog een synthetisch ontwerp waarvan bewezen is dat het overeenkomt met het computationele ontwerp met zowel kleine-hoekoplossingsstudies als röntgenverstrooiing."
Dit werk, samen met de gebogen bèta-plaat en trimere metalloproteïne-ontwerpen, de mogelijkheden voor de ontwikkeling van nieuwe therapieën en biomaterialen te verbreden.
 Chemische katalysator verandert afval in schat, inerte C-H-bindingen reactief maken
Chemische katalysator verandert afval in schat, inerte C-H-bindingen reactief maken Nieuwe keramische nanovezelsponzen kunnen worden gebruikt voor flexibele isolatie, water Zuivering
Nieuwe keramische nanovezelsponzen kunnen worden gebruikt voor flexibele isolatie, water Zuivering Krachtige laserdiodes kunnen restspanning in 3D-geprinte metalen onderdelen verminderen
Krachtige laserdiodes kunnen restspanning in 3D-geprinte metalen onderdelen verminderen Wetenschappers ontwikkelen nieuwe aanpak om te voorspellen hoe vloeistoffen bevriezen
Wetenschappers ontwikkelen nieuwe aanpak om te voorspellen hoe vloeistoffen bevriezen Fluor stroomt naar binnen, maakt materiaal metaal
Fluor stroomt naar binnen, maakt materiaal metaal
 Klimaatverandering brengt zomerhitte naar het vroege voorjaar van Florida
Klimaatverandering brengt zomerhitte naar het vroege voorjaar van Florida Gouden nanostaafjes kunnen worden gebruikt om kleinere draagbare kwiksensoren te ontwikkelen
Gouden nanostaafjes kunnen worden gebruikt om kleinere draagbare kwiksensoren te ontwikkelen Video:oplossingen voor koolstofbeheer ontwikkelen
Video:oplossingen voor koolstofbeheer ontwikkelen Nieuwe methode schat risico's van hormoonverstorende stoffen in drinkwater in
Nieuwe methode schat risico's van hormoonverstorende stoffen in drinkwater in Op welke manieren heeft geografie en klimaat de ontwikkeling van de menselijke samenleving beïnvloed?
Op welke manieren heeft geografie en klimaat de ontwikkeling van de menselijke samenleving beïnvloed?
Hoofdlijnen
- Sonic Kayaks:Milieumonitoring en experimentele muziek door burgers
- Minimale zuurstofconcentratie voor menselijke ademhaling
- Genetisch manipulatiemechanisme gevisualiseerd
- Een omkeerbare hoofdschakelaar ontdekken voor ontwikkeling
- Wat zijn de voordelen en nadelen van Flow Cytometry?
- Specialiteiten van de rechterkant van de hersenen
- Ongedierteresistentie tegen biotech-gewassen stijgt
- Archaea: Structure, Characteristics & Domain
- Alles in de familie:gerichte genomische vergelijkingen
- Polymeren kunnen gebouwen beschermen tegen grote breuken

- Nieuwe, op chips gebaseerde tool voor genexpressie analyseert RNA snel en nauwkeurig

- Corrosieweerstand van roestvrij staal tot zwavelzuur

- Nieuwe fluorescerende kleurstoffen kunnen biologische beeldvorming bevorderen

- Onderzoekers publiceren routekaart om datawetenschap en kunstmatige intelligentie te benutten voor elektronenmicroscopie

 Röntgenstralen vergroten de eiwitstructuur in het hart van het COVID-19-virus
Röntgenstralen vergroten de eiwitstructuur in het hart van het COVID-19-virus Digitalisering blijkt een belangrijk klimaatinstrument te zijn
Digitalisering blijkt een belangrijk klimaatinstrument te zijn Lijnzaadachtige deeltjes kunnen nu bot groeien, kraakbeenweefsels voor mensen
Lijnzaadachtige deeltjes kunnen nu bot groeien, kraakbeenweefsels voor mensen Eerste gerapporteerde optreden en behandeling van medisch risico van ruimtevluchten 200+ mijl boven de aarde
Eerste gerapporteerde optreden en behandeling van medisch risico van ruimtevluchten 200+ mijl boven de aarde Horzels lokken:wetenschappers ontsluiten seksferomoon van berucht honingbij-roofdier
Horzels lokken:wetenschappers ontsluiten seksferomoon van berucht honingbij-roofdier Nieuwsgierig,
Nieuwsgierig,  Infrarood NASA-beeld onthult de kracht van orkaan Fabios
Infrarood NASA-beeld onthult de kracht van orkaan Fabios Wat u kunt doen om plasticvervuiling tegen te gaan
Wat u kunt doen om plasticvervuiling tegen te gaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

