
Wetenschap
Hoe een van de X-chromosomen in vrouwelijke embryonale stamcellen tot zwijgen wordt gebracht
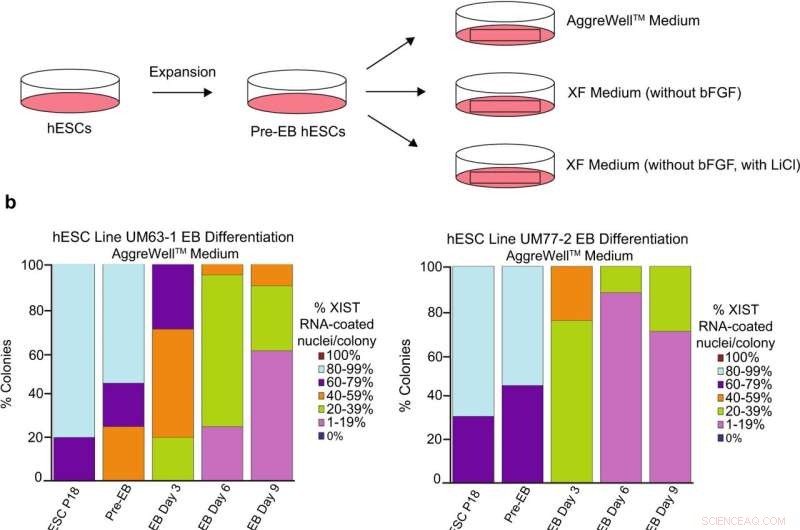
Analyse van XIST RNA-coating tijdens differentiatie van vrouwelijke hESC's. een schema van hESC-differentiatie in embryoïde lichamen (EB's) met drie verschillende mediaformuleringen:een in de handel verkrijgbare AggreWell TM medium; XF-medium zonder bFGF; en XF-medium zonder bFGF maar met 0,98 mM LiCl. b Percentage kernen met XIST RNA-coating in EB's gegenereerd uit hESC-lijnen UM77-2 en UM63-1. EB's gegenereerd en gekweekt in XF-medium met LiCl en AggreWell TM medium verloor een aanzienlijk deel van XIST RNA-coating per kolonie in vergelijking met EB's gegenereerd en gekweekt in XF-medium (algemene lineaire modelvergelijking; p < 0.001). Ten minste 100 kernen werden per kolonie geteld voor kwantificering van hESC RNA FISH. Het totale aantal kolonies gekwantificeerd bij elke passage varieert tussen 10 en 17 en is gecatalogiseerd in brongegevens. Brongegevens worden geleverd als een brongegevensbestand. Krediet:Natuurcommunicatie (2022). DOI:10.1038/s41467-022-30259-x
Bij de meeste zoogdieren hebben vrouwtjes twee X-chromosomen en mannetjes één X- en één Y-chromosoom in elk van hun cellen. Om een dubbele dosis X-gebonden genen bij vrouwen te voorkomen, wordt een van de X's vroeg in het ontwikkelingsproces tot zwijgen gebracht. Dit tot zwijgen brengen is van cruciaal belang, maar hoe het gebeurt is relatief mysterieus. Twee nieuwe U-M-onderzoeken onthullen meer over dit silencing-proces en inzichten die stamcelonderzoek kunnen verbeteren.
Menselijke embryonale stamcellen (hESC's) zijn veelbelovend voor onderzoek naar vroege ontwikkeling en voor regeneratieve geneeskunde voor ziekten variërend van type 1 diabetes tot de ziekte van Parkinson. Toch lopen biologen die met vrouwelijke hESC's in het laboratorium werken, vaak tegen een fenomeen aan waarbij het normaal geïnactiveerde X-chromosoom deze onderdrukking verliest terwijl het in een kweekschaal groeit.
"Als je hESC's niet precies als zodanig in cultuur kunt houden, kun je ze niet gebruiken voor stroomafwaartse toepassingen", zegt Sundeep Kalantry, Ph.D., universitair hoofddocent menselijke genetica. Hij, samen met Marissa Cloutier, een Ph.D. stagiair en hun team gingen op zoek naar de reden waarom X-inactivatie in de loop van de tijd onder bepaalde experimentele omstandigheden afbrokkelt.
Hun hoofdverdachte was de stof die werd gebruikt om de cellen in cultuur te laten groeien, media genaamd. Cellen worden gekweekt in media die hen voorzien van chemische instructies die groeifactoren worden genoemd. Deze groeifactoren signaleren stamcellen om te blijven delen. Een populair medium, mTeSR1 genaamd, bleek gecorreleerd te zijn met het verlies van een belangrijke regulator van X-inactivatie, een niet-coderende RNA-streng genaamd XIST. Een ander medium, Xenofree genaamd, leidde niet tot verlies van X-inactivatie.
"We hebben gekeken naar de verschillen in de samenstelling van deze twee media en hebben vastgesteld dat lithiumchloride wel aanwezig is in mTeSR1 maar niet in Xenofree", zegt Cloutier.
Lithiumchloride wordt soms in media opgenomen om de proliferatie van stamcellen te bevorderen, maar het is bekend dat het interfereert met veel celsignaleringsroutes door GSK-3-eiwitten te remmen. (Remmers van GSK-3-eiwitten zijn gebruikt om verschillende ziekten te behandelen, en lithium, dat werd gebruikt om bipolaire stoornis te behandelen, was een van de eerste natuurlijke GSK-3-remmers die werd ontdekt.)
Om te bevestigen dat lithiumchloride de boosdoener was, voegden ze de verbinding toe aan het Xenofree-medium en zagen een verlies van X-inactivatie. Hun paper is gepubliceerd in Nature Communications .
"Over het algemeen in termen van ons begrip van X-inactivatie, biedt onze studie een mogelijk nieuw model voor de regulering van dit proces", zegt Cloutier. Kalantry voegt eraan toe dat hun studie suggereert dat onderzoekers wat voorzichtiger moeten zijn met het gebruik van GSK-3-remmers zoals lithium. "Ze kunnen niet alleen de inactivatie van X verstoren, maar ook andere vormen van epigenetische transcriptionele regulatie over het genoom."
De rol van een oud X-gebonden gen bij het induceren van X-inactivatie
Een apart artikel, ook gepubliceerd in Nature Communications door Kalantry en collega's, geeft inzicht in de evolutie van X-inactivatie bij zoogdieren. Het uitgangspunt van de studie was dat X-inactivatie wordt veroorzaakt door een of meer van een subset van X-gebonden genen die paradoxaal genoeg aan X-inactivatie ontsnappen zodra X-inactivatie is begonnen. Deze genen komen tot expressie van beide X-chromosomen bij vrouwen versus een enkele X bij mannen, en komen daardoor sterker tot expressie bij vrouwen dan bij mannen. Kalantry's lab in nauwe samenwerking met Shigeki Iwase's lab, ook aan de Universiteit van Michigan, ontdekte dat vanwege de hogere expressie bij vrouwen versus mannen van een dergelijk X-gebonden gen, Kdm5c, het Xist en dus X-inactivatie selectief induceert bij vrouwen .
Door Kdm5c op beide X-chromosomen in een vrouwelijke cel te verwijderen, werd X-inactivatie bijna volledig uitgeschakeld. Omgekeerd, toen de onderzoekers Kdm5c in mannelijke muiscellen introduceerden, startten ze met succes X-inactivatie, wat onder normale omstandigheden niet zou plaatsvinden.
Kdm5c is een voorouderlijk X-gebonden gen dat wordt gedeeld door alle zoogdiersoorten. De auteurs testten en ontdekten dat Kdm5c van evolutionair verre buideldier- en monotreme (bijv. het eierleggende vogelbekdier) zoogdierlijnen, die meer dan 150 miljoen jaar geleden uit placentale zoogdieren zijn afgesplitst, ook opmerkelijk Xist- en X-inactivatie in mannelijke muiscellen kan induceren . Deze bevinding suggereert dat Kdm5c een voorouderlijke functie heeft behouden om Xist- en X-inactivatie bij muizen en mensen te induceren.
"Als X-gebonden genen op hogere dan normale niveaus tot expressie worden gebracht in een vrouwelijke cel, zal die cel vaak lijden en sterven. cellen lijden ook en sterven af', zegt Kalantry. "Het juiste niveau van X-chromosoomgenen is echt heel belangrijk voor de gezondheid van de cel."
Het team hoopt vervolgens het willekeurige proces te verklaren dat bepaalt welke X in een vrouwelijke cel het zwijgen wordt opgelegd:die van de moeder of die van de vader. Het bepalen van dit basismechanisme, zegt Kalantry, zou in de toekomst kunnen worden toegepast om X-gebonden genen naar believen te reactiveren voor potentiële therapeutische doeleinden.
 Wetenschappers hebben een ongrijpbare verwarde knoop van DNA opgespoord
Wetenschappers hebben een ongrijpbare verwarde knoop van DNA opgespoord Kleine filters helpen bij het opsporen van kankerachtige bloedcellen
Kleine filters helpen bij het opsporen van kankerachtige bloedcellen Wetenschappers construeren zeer sterke microbuis door coaxiaal printen met aangepaste biohybird hydrogel-inkt
Wetenschappers construeren zeer sterke microbuis door coaxiaal printen met aangepaste biohybird hydrogel-inkt Fujitsu ontwikkelt moleculaire simulatietechnologie om effectief nieuwe kandidaat-geneesmiddelen te creëren
Fujitsu ontwikkelt moleculaire simulatietechnologie om effectief nieuwe kandidaat-geneesmiddelen te creëren Groenere waterstof uit water
Groenere waterstof uit water
Hoofdlijnen
- Het gebruik van kwallenbloei als oplossing voor het maken van nieuwe producten
- Waarom haten sommige mensen het geluid van kauwen? Wetenschappers hebben misschien het antwoord
- Als je asperges kunt ruiken in de urine,
- Begrijpen? Je hersensignalen zullen het vertellen
- 10 verschillende soorten lachen
- Bestaan er nog grote onontdekte soorten?
- De Pomodoro-techniek:je kunt elke taak 25 minuten per keer aan
- Hoe wordt recombinant DNA gemaakt?
- Hoe de Galapagos-eilanden werken
- Het verschil tussen orthologe en paralogische genen

- Kunstmatige neurale netwerken kunnen het beheer van natuurhistorische collecties stimuleren

- Hoe Dopamine sommige voedingsmiddelen verslavend maakt

- De verschillen tussen monosachariden en polysachariden

- Wetenschappers ontdekken fossielen van gigantische zeehagedis die 66 miljoen jaar geleden over de oceanen heerste

 Wat zijn de eerste eukaryote fossielen?
Wat zijn de eerste eukaryote fossielen?  Voor de eerste keer, onderzoekers meten eigenschappen van water bij diep onderkoelde temperaturen
Voor de eerste keer, onderzoekers meten eigenschappen van water bij diep onderkoelde temperaturen De opkomst van Cahokia's loopt parallel met het begin van de maïslandbouw
De opkomst van Cahokia's loopt parallel met het begin van de maïslandbouw Wat zit er in de Amazon-doos? Misschien een echte 7-voet kerstboom
Wat zit er in de Amazon-doos? Misschien een echte 7-voet kerstboom Kan het verbergen van likes Facebook eerlijker maken en nepnieuws in toom houden? De wetenschap zegt misschien
Kan het verbergen van likes Facebook eerlijker maken en nepnieuws in toom houden? De wetenschap zegt misschien bedrog, ontheemde Amerikanen verlangen ernaar naar huis terug te keren na orkaan
bedrog, ontheemde Amerikanen verlangen ernaar naar huis terug te keren na orkaan Hoe beweegt een Clam?
Hoe beweegt een Clam?  Foto mijnbouw
Foto mijnbouw
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

