Wetenschap
Wetenschappers ontdekken boodschapper-RNA met twee functies
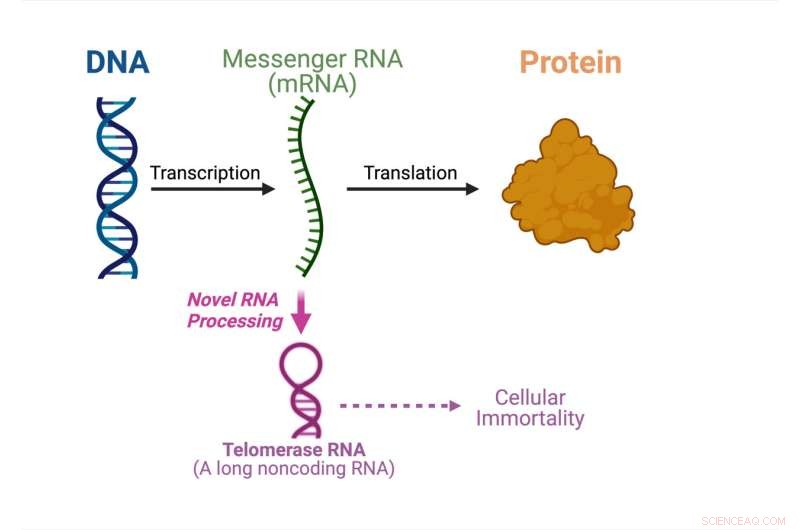
Het centrale dogma van de moleculaire biologie die laat zien wat er in deze studie gebeurt. Krediet:Julian Chen
Voor de allereerste keer heeft een onderzoek onder leiding van Julian Chen en zijn groep aan de School of Molecular Sciences van de Arizona State University en het Center for the Mechanism of Evolution van het Biodesign Institute een ongekende route ontdekt die telomerase-RNA produceert uit een eiwitcoderend boodschapper-RNA ( mRNA).
Het centrale dogma van de moleculaire biologie specificeert de volgorde waarin genetische informatie wordt overgedragen van DNA om eiwitten te maken. Messenger RNA-moleculen dragen de genetische informatie van het DNA in de celkern naar het cytoplasma waar de eiwitten worden gemaakt. Messenger RNA fungeert als de boodschapper om eiwitten te bouwen.
"Eigenlijk zijn er veel RNA's (ribonucleïnezuren) die niet worden gebruikt om eiwitten te maken", legt Chen uit. "Ongeveer 70 procent van het menselijk genoom wordt gebruikt om niet-coderende RNA's te maken die niet coderen voor eiwitsequenties maar andere toepassingen hebben."
Telomerase-RNA is een van de niet-coderende RNA's die samen met telomerase-eiwitten samenkomen om het enzym telomerase te vormen. Telomerase is cruciaal voor cellulaire onsterfelijkheid bij kanker en stamcellen. In deze studie laat de groep van Chen zien dat een schimmeltelomerase-RNA wordt verwerkt vanuit een eiwitcoderend mRNA, in plaats van onafhankelijk te worden gesynthetiseerd.
"Onze bevinding uit dit artikel is een paradigmaverschuiving. De meeste RNA-moleculen worden onafhankelijk gesynthetiseerd en hier hebben we een mRNA met dubbele functie ontdekt dat kan worden gebruikt om een eiwit te produceren of om een niet-coderend telomerase-RNA te maken, wat echt uniek is," zei Chen. "We zullen veel meer onderzoek moeten doen om het onderliggende mechanisme van zo'n ongebruikelijke RNA-biogenese-route te begrijpen."
Fundamenteel onderzoek naar het metabolisme en de regulatie van mRNA heeft geleid tot belangrijke medische toepassingen. Verschillende COVID-19-vaccins gebruiken bijvoorbeeld boodschapper-RNA als middel om virale spike-eiwitten te produceren. In deze vaccins worden de mRNA-moleculen uiteindelijk afgebroken en vervolgens door ons lichaam opgenomen.
Deze nieuwe benadering heeft voordelen ten opzichte van DNA-vaccins die het potentiële risico lopen om schadelijk en permanent in ons DNA te worden opgenomen. De ontdekking van mRNA-biogenese met twee functies in dit werk zou kunnen leiden tot innovatieve manieren om toekomstige mRNA-vaccins te maken.
In deze studie ontdekte de groep van Chen het onverwachte van mRNA afgeleide telomerase-RNA in het schimmelmodelorganisme Ustilago maydis of maïs vuil. Corn smut, ook wel Mexicaanse truffel genoemd, is eetbaar en geeft een heerlijk umami-effect aan veel gerechten, bijvoorbeeld tamales en taco's. De studie van RNA- en telomeerbiologie in maïsvuil kan kansen bieden voor het vinden van nieuwe mechanismen voor mRNA-metabolisme en telomerasebiogenese.
Waarom telomerase-RNA bestuderen?
De Nobelprijs voor Fysiologie of Geneeskunde werd in 2009 toegekend "voor de ontdekking van hoe chromosomen worden beschermd door telomeren en het enzym telomerase." Telomerase werd voor het eerst geïsoleerd uit een eencellig organisme dat in vijverresten leefde. Zoals later bleek, komt telomerase voor in bijna alle eukaryote organismen, inclusief de mens, en speelt het een cruciale rol bij veroudering en kanker. Wetenschappers zijn op zoek naar manieren om telomerase te gebruiken om menselijke cellen onsterfelijk te maken.
Typische menselijke cellen zijn sterfelijk en kunnen zichzelf niet voor altijd vernieuwen. Zoals Leonard Hayflick een halve eeuw geleden aantoonde, hebben menselijke cellen een beperkte replicatieve levensduur, waarbij oudere cellen deze limiet eerder bereiken dan jongere cellen. Deze "Hayflick-limiet" van de cellulaire levensduur houdt rechtstreeks verband met het aantal unieke DNA-herhalingen dat wordt gevonden aan de uiteinden van de chromosomen die genetisch materiaal bevatten. Deze DNA-herhalingen maken deel uit van de beschermende afdekstructuren, 'telomeren' genoemd, die de uiteinden van chromosomen beschermen tegen ongewenste en ongerechtvaardigde DNA-herschikkingen die het genoom destabiliseren.
Elke keer dat de cel zich deelt, krimpt het telomere DNA en zal het uiteindelijk niet lukken om de chromosoomuiteinden vast te zetten. Deze continue vermindering van de telomeerlengte functioneert als een "moleculaire klok" die aftelt tot het einde van de celgroei.
Het verminderde vermogen van cellen om te groeien is sterk geassocieerd met het verouderingsproces, waarbij de verminderde celpopulatie direct bijdraagt aan zwakte, ziekte en orgaanfalen.
Het tegengaan van het telomeerkrimpproces is telomerase, het enzym dat op unieke wijze de sleutel bevat tot het vertragen of zelfs omkeren van het cellulaire verouderingsproces. Telomerase compenseert cellulaire veroudering door de telomeren te verlengen, verloren DNA-herhalingen toe te voegen om tijd toe te voegen aan het aftellen van de moleculaire klok, waardoor de levensduur van de cel effectief wordt verlengd.
Telomerase verlengt telomeren door herhaaldelijk zeer korte DNA-herhalingen van zes nucleotiden - de bouwstenen van DNA - te synthetiseren met de sequentie "GGTTAG" op de chromosoomuiteinden vanuit een sjabloon dat zich in de RNA-component van het enzym zelf bevindt.
Het geleidelijk krimpen van telomeren heeft een negatieve invloed op het replicatievermogen van menselijke stamcellen, de cellen die beschadigde weefsels herstellen en/of verouderende organen in ons lichaam aanvullen. De activiteit van telomerase in volwassen stamcellen vertraagt alleen het aftellen van de moleculaire klok en vereeuwigt deze cellen niet volledig. Daarom raken volwassen stamcellen uitgeput bij oudere personen als gevolg van verkorting van de telomeerlengte, wat resulteert in langere genezingstijden en afbraak van orgaanweefsel door onvoldoende celpopulaties.
Het volledige potentieel van telomerase benutten
Het begrijpen van de regulatie en beperking van het telomerase-enzym houdt de belofte in van het omkeren van telomeerverkorting en cellulaire veroudering met het potentieel om de levensduur van de mens te verlengen en het welzijn van oudere personen te verbeteren.
Ziekten bij de mens, waaronder congenita dyskeratosis, aplastische anemie en idiopathische longfibrose, zijn genetisch in verband gebracht met mutaties die de telomerase-activiteit negatief beïnvloeden en/of het verlies van telomeerlengte versnellen. Deze versnelde telomeerverkorting lijkt sterk op vroegtijdige veroudering met verhoogde orgaanverslechtering en een verkorte levensduur van de patiënt veroorzaakt door kritisch onvoldoende stamcelpopulaties. Het verhogen van de telomerase-activiteit is schijnbaar de meest veelbelovende manier om deze genetische ziekten te behandelen.
Hoewel een verhoogde telomerase-activiteit de jeugd naar verouderende cellen kan brengen en vroegtijdige, op veroudering lijkende ziekten kan genezen, kan te veel van het goede schadelijk zijn voor het individu. Net zoals jeugdige stamcellen telomerase gebruiken om telomeerlengteverlies te compenseren, gebruiken kankercellen telomerase om hun afwijkende en destructieve groei te behouden. Het vergroten en reguleren van de telomerasefunctie zal met precisie moeten worden uitgevoerd, waarbij een smalle lijn moet worden bewandeld tussen celverjonging en een verhoogd risico op de ontwikkeling van kanker.
Verschillend van menselijke stamcellen, vormen somatische cellen de overgrote meerderheid van de cellen in het menselijk lichaam en missen telomerase-activiteit. De telomerasedeficiëntie van menselijke lichaamscellen vermindert het risico op kankerontwikkeling, omdat telomerase de ongecontroleerde groei van kankercellen stimuleert. Daarom zijn geneesmiddelen die de telomerase-activiteit zonder onderscheid in alle celtypen verhogen, niet gewenst. Geneesmiddelen met kleine moleculen kunnen worden gescreend of ontworpen om de telomerase-activiteit uitsluitend in stamcellen te verhogen voor de behandeling van ziekten en voor antiverouderingstherapieën zonder het risico op kanker te vergroten.
De studie van telomerase-RNA-biogenese in maïsvuil kan nieuwe mechanismen voor telomeraseregulatie onthullen en nieuwe richtingen bieden voor het moduleren of engineeren van menselijke telomerase voor innovaties bij het ontwikkelen van anti-aging en antikankertherapieën.
Deze studie, "Biogenese van telomerase-RNA van een eiwitcoderende mRNA-precursor", is zojuist gepubliceerd in de Proceedings of the National Academy of Sciences . Het ASU-team bestaat uit eerste auteurs, postdoc Dhenugen Logeswaran en voormalig onderzoeksassistent-professor Yang Li, doctoraalstudent Khadiza Akhter, voormalig postdoc Joshua Podlevsky (momenteel bij Sandia National Labs, Albuquerque, New Mexico) en twee studenten Tamara Olson en Katherine Fosberg.
Chen gaf ook commentaar op het kaliber van de ASU-studenten, Tamara Olson en Katherine Fosberg, die meer dan een jaar in zijn laboratorium werkten. "Ze brachten veel tijd door in het lab en waren volledig betrokken bij ons onderzoek." + Verder verkennen
Wat kreeften ons kunnen leren over onsterfelijkheid
Hoofdlijnen
- Fungus Vs. Mold
- Verschillen tussen codering en sjabloondraden
- Mannetjes passen de snelheid van het sperma snel aan om rivalen te verslaan, studie vondsten
- Nieuwe studie voorspelt wereldwijde verandering in ondiepe rifecosystemen als het water warmer wordt
- Niet genoeg:bescherming van algenetende vissen onvoldoende om bedreigde koraalriffen te redden, concludeert studie
- Waarom is een atom elektrisch neutraal?
- Nieuwe techniek helpt te ontdekken of bacteriën die meningitis veroorzaken resistent zijn tegen antibiotica
- Dolfijnen- en berenstudies maken de weg vrij voor verbeterde populatieprognoses
- Welke soorten cellen zijn bacteriën?
 Hoe zijn reptielen en amfibieën identiek
Hoe zijn reptielen en amfibieën identiek  Onderzoek bekijkt hoe consumenten reageren op bepaalde verkooppromoties in de detailhandel
Onderzoek bekijkt hoe consumenten reageren op bepaalde verkooppromoties in de detailhandel Dieren die leven in de Canopy Layer of the Rainforest
Dieren die leven in de Canopy Layer of the Rainforest  Antropoloog onderzoekt hoe hitte de fysieke en mentale gezondheid van Noord-Texanen beïnvloedt
Antropoloog onderzoekt hoe hitte de fysieke en mentale gezondheid van Noord-Texanen beïnvloedt Klimaatverandering om huishoudbudgetten op te rekken
Klimaatverandering om huishoudbudgetten op te rekken Zoeken naar discrete tijdkristallen in klassieke veellichamensystemen
Zoeken naar discrete tijdkristallen in klassieke veellichamensystemen Voornaamwoorden zijn belangrijk - het gebruik van voornaamwoorden brengt inclusiviteit over
Voornaamwoorden zijn belangrijk - het gebruik van voornaamwoorden brengt inclusiviteit over Wetenschapsprojecten met een prisma
Wetenschapsprojecten met een prisma
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com