
Wetenschap
Grafeenoxide-nanovlokken verminderen de toxiciteit van Alzheimer-eiwitten, blijkt uit onderzoek
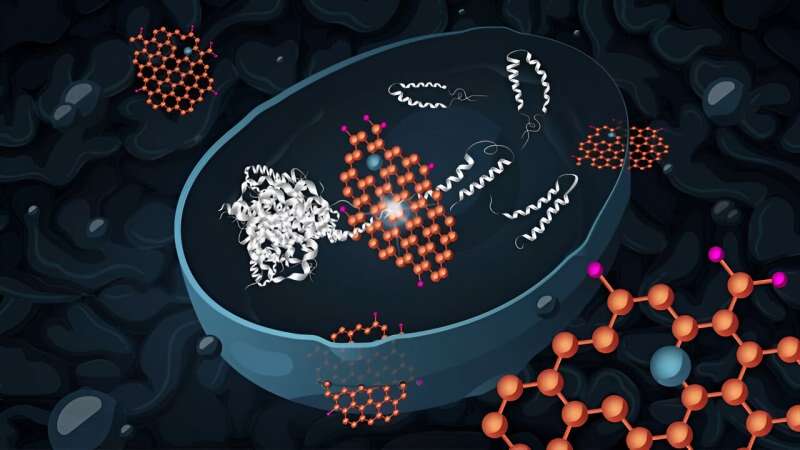
Een waarschijnlijke vroege oorzaak van de ziekte van Alzheimer is de ophoping van moleculen die amyloïde peptiden worden genoemd. Deze veroorzaken celdood en worden vaak aangetroffen in de hersenen van Alzheimerpatiënten. Onderzoekers van de Chalmers University of Technology in Zweden hebben nu aangetoond dat gistcellen die deze verkeerd gevouwen amyloïde peptiden accumuleren, kunnen herstellen na behandeling met grafeenoxide-nanovlokken.
Eiwitten en peptiden zijn fundamenteel hetzelfde type molecuul en bestaan uit aminozuren. Peptidemoleculen zijn kleiner – bevatten doorgaans minder dan 50 aminozuren – en hebben een minder gecompliceerde structuur. Eiwitten en peptiden kunnen allebei vervormd raken als ze tijdens de vorming in de cel verkeerd vouwen. Wanneer veel amyloïde-bèta-peptiden zich ophopen in de hersenen, worden de aggregaten geclassificeerd als eiwitten.
De ziekte van Alzheimer is een ongeneeslijke hersenziekte, die leidt tot dementie en de dood, en lijden veroorzaakt voor zowel de patiënten als hun families. Naar schatting leven ruim 40 miljoen mensen wereldwijd met de ziekte of een daaraan gerelateerde vorm van dementie. Volgens Alzheimer's News Today bedragen de geschatte mondiale kosten van deze ziekten 1% van het mondiale bruto binnenlands product.
Aangenomen wordt dat verkeerd gevouwen amyloïde-bèta-peptiden, Aβ-peptiden, die zich ophopen en aggregeren in de hersenen, de onderliggende oorzaak zijn van de ziekte van Alzheimer. Ze veroorzaken een reeks schadelijke processen in de neuronen (hersencellen) – waardoor veel vitale celfuncties verloren gaan of celdood ontstaat, en dus de hersenfunctie in het getroffen gebied verloren gaat. Tot op heden zijn er geen effectieve strategieën om de accumulatie van amyloïde in de hersenen te behandelen.
Onderzoekers van de Chalmers University of Technology hebben nu aangetoond dat behandeling met grafeenoxide leidt tot verlaagde niveaus van geaggregeerde amyloïde peptiden in een gistcelmodel. Het onderzoek is gepubliceerd in het tijdschrift Advanced Functional Materials .
“Dit effect van grafeenoxide is onlangs ook door andere onderzoekers aangetoond, maar niet in gistcellen”, zegt Xin Chen, onderzoeker in systeembiologie bij Chalmers en eerste auteur van het onderzoek. "Onze studie verklaart ook het mechanisme achter het effect. Grafeenoxide beïnvloedt het metabolisme van de cellen, op een manier die hun weerstand tegen verkeerd gevouwen eiwitten en oxidatieve stress verhoogt. Dit is niet eerder gerapporteerd."
Onderzoek naar de mechanismen die gebruik maken van bakkersgist die wordt beïnvloed door de ziekte van Alzheimer
Bij de ziekte van Alzheimer oefenen de amyloïdeaggregaten hun neurotoxische effecten uit door verschillende cellulaire metabolische stoornissen te veroorzaken, zoals stress in het endoplasmatisch reticulum – een groot deel van de cel, waarin veel van zijn eiwitten worden geproduceerd. Dit kan het vermogen van cellen om verkeerd gevouwen eiwitten te verwerken verminderen, en bijgevolg de accumulatie van deze eiwitten vergroten.
De aggregaten beïnvloeden ook de functie van de mitochondriën, de krachtcentrales van de cellen. Daarom worden de neuronen blootgesteld aan verhoogde oxidatieve stress (reactieve moleculen die zuurstofradicalen worden genoemd en die andere moleculen beschadigen); iets waarvoor hersencellen bijzonder gevoelig zijn.
De Chalmers-onderzoekers hebben het onderzoek uitgevoerd door een combinatie van eiwitanalyse (proteomics) en vervolgexperimenten. Ze hebben bakkersgist, Saccharomyces cerevisiae, gebruikt als een in vivo model voor menselijke cellen. Beide celtypen hebben zeer vergelijkbare systemen voor het controleren van de eiwitkwaliteit. Dit gistcelmodel werd eerder door de onderzoeksgroep ontwikkeld om menselijke neuronen na te bootsen die zijn aangetast door de ziekte van Alzheimer.
"De gistcellen in ons model lijken op neuronen die worden beïnvloed door de accumulatie van amyloïde-beta42, de vorm van amyloïde peptide die het meest vatbaar is voor aggregaatvorming", zegt Xin Chen. "Deze cellen verouderen sneller dan normaal, vertonen endoplasmatisch reticulumstress en mitochondriale disfunctie, en hebben een verhoogde productie van schadelijke reactieve zuurstofradicalen."
Hoge verwachtingen voor nanovlokken van grafeenoxide
Grafeenoxide-nanovlokken zijn tweedimensionale koolstofnanomaterialen met unieke eigenschappen, waaronder uitstekende geleidbaarheid en hoge biocompatibiliteit. Ze worden op grote schaal gebruikt in verschillende onderzoeksprojecten, waaronder de ontwikkeling van kankerbehandelingen, systemen voor medicijnafgifte en biosensoren.
De nanovlokken zijn hydrofiel (wateroplosbaar) en werken goed samen met biomoleculen zoals eiwitten. Wanneer grafeenoxide levende cellen binnendringt, kan het de zelfassemblageprocessen van eiwitten verstoren.
"Als gevolg hiervan kan het de vorming van eiwitaggregaten belemmeren en de desintegratie van bestaande aggregaten bevorderen", zegt Santosh Pandit, onderzoeker in systeembiologie bij Chalmers en co-auteur van de studie. "Wij geloven dat de nanovlokken via twee onafhankelijke routes werken om de toxische effecten van amyloïde-beta42 in de gistcellen te verzachten."
In één route werkt grafeenoxide rechtstreeks om de accumulatie van amyloïde-bèta42 te voorkomen. In het andere geval werkt grafeenoxide indirect via een (op dit moment onbekend) mechanisme, waarbij specifieke genen voor stressreactie worden geactiveerd. Dit vergroot het vermogen van de cel om verkeerd gevouwen eiwitten en oxidatieve stress te verwerken.
Hoe Alzheimerpatiënten moeten worden behandeld is nog steeds een vraag voor de toekomst. Volgens de onderzoeksgroep van Chalmers heeft grafeenoxide echter een groot potentieel voor toekomstig onderzoek op het gebied van neurodegeneratieve ziekten. De onderzoeksgroep heeft in een gistmodel al kunnen aantonen dat behandeling met grafeenoxide ook de toxische effecten van eiwitaggregaten die specifiek zijn voor de ziekte van Huntington vermindert.
"De volgende stap is onderzoeken of het mogelijk is een medicijnafgiftesysteem te ontwikkelen op basis van grafeenoxide voor de ziekte van Alzheimer." zegt Xin Chen. "We willen ook testen of grafeenoxide gunstige effecten heeft in aanvullende modellen van neurodegeneratieve ziekten, zoals de ziekte van Parkinson."
Meer informatie: Xin Chen et al., Grafeenoxide verzwakt de toxiciteit van amyloïde-β-aggregaten in gist door de demontage te bevorderen en de respons op cellulaire stress te stimuleren, Geavanceerde functionele materialen (2023). DOI:10.1002/adfm.202304053
Journaalinformatie: Geavanceerde functionele materialen
Aangeboden door Chalmers University of Technology
 NASA volgt Jose die meandert voor de oostkust van de VS
NASA volgt Jose die meandert voor de oostkust van de VS Studie meet het potentieel van bomen om de opwarming van de aarde in de toekomst te vertragen
Studie meet het potentieel van bomen om de opwarming van de aarde in de toekomst te vertragen Lekkage in de Oostzee-pijpleiding schaadt het leven in zee en het klimaat
Lekkage in de Oostzee-pijpleiding schaadt het leven in zee en het klimaat Australië op koers voor ongekende decennialange megadroogtes, blijkt uit modelstudie
Australië op koers voor ongekende decennialange megadroogtes, blijkt uit modelstudie  De elektriciteitssector in Australië moet de CO2-uitstoot tegen 2030 met 45% verminderen
De elektriciteitssector in Australië moet de CO2-uitstoot tegen 2030 met 45% verminderen
Hoofdlijnen
- Ontdekt? Nieuw maar uitgestorven menselijk familielid uit Melanesië
- Fysieke aanpassingen van rondwormen
- Gloeiende tags onthullen een fractie van een seconde activiteit van pathogene circuits
- Genduplicatie die de celdeling lijkt te vertragen, zorgt ervoor dat Groenlandse walvissen langer leven
- Creatief beheer van begrazing door het gebruik van kleine branden
- Wat is de functie van de promotor in de transcriptie van DNA?
- Onderzoekers verhelderen de ruimtelijke structuur en moleculaire mechanismen van Prime Editor, een nieuw hulpmiddel voor het bewerken van genen
- Hoe het uitsterven van de dinosauriërs de evolutie van planten veranderde
- Vrijwilligers bevrijden een Australische rivier van het ligusterprobleem en versterken onderweg de gemeenschap
- Nu zie je het:observatie in de echte ruimte van protontunneling met veel lichamen in waternanocluster
- Fotosynthetische op bacteriën gebaseerde kankeroptotheranostics
- Zonnebrand, genees uzelf:Exosoomtherapie kan een beter herstel van de zon mogelijk maken, door ouderdom beschadigde huid
- Koolstof nanobuisjes als transistormateriaal
- Chemici ontdekken eenvoudigere methode om wondermateriaal te maken

 Onderzoekers stellen bibliotheek van suikers samen
Onderzoekers stellen bibliotheek van suikers samen Slechts acht EU-landen om steenkool tegen 2030 uit te faseren
Slechts acht EU-landen om steenkool tegen 2030 uit te faseren Gouden nanodeeltjes blijken hersentekorten bij multiple sclerose en Parkinson om te keren
Gouden nanodeeltjes blijken hersentekorten bij multiple sclerose en Parkinson om te keren  Een multi-granulariteit redeneringskader voor herkenning van sociale relaties
Een multi-granulariteit redeneringskader voor herkenning van sociale relaties Team ontwikkelt ultradunne sensor die het testen en genezen van ontstekingen 30 keer sneller maakt
Team ontwikkelt ultradunne sensor die het testen en genezen van ontstekingen 30 keer sneller maakt Onder de radar:op zoek naar onopvallende supersymmetrie
Onder de radar:op zoek naar onopvallende supersymmetrie Fossiele kevers suggereren dat het klimaat in LA al 50 jaar relatief stabiel is, 000 jaar
Fossiele kevers suggereren dat het klimaat in LA al 50 jaar relatief stabiel is, 000 jaar Een neonreclame testen Transformer
Een neonreclame testen Transformer
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

