
Wetenschap
CRISPR-aangedreven optothermische nanopincet
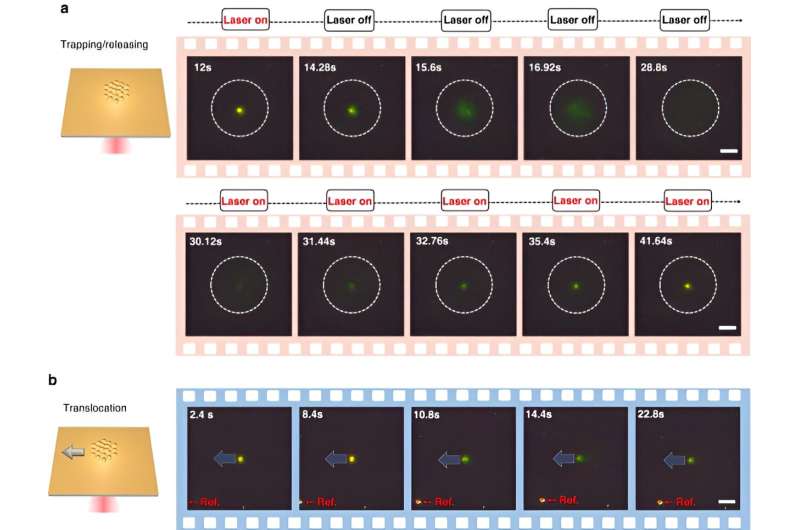
Optothermische nanopincetten zijn een innovatieve optische ontwerpmethode die een revolutie teweeg heeft gebracht in klassieke optische technieken om een breed scala aan nanodeeltjes te vangen. Hoewel het optothermische temperatuurveld kan worden gebruikt voor in situ regulering van nanodeeltjes, blijven er uitdagingen bestaan bij het identificeren van hun potentieel voor het reguleren van bionanodeeltjes.
Om de synergetische effecten van optothermische manipulatie en op Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) gebaseerde biodetectie te observeren, ontwikkelden de onderzoekers een combinatie van CRISPR-aangedreven optothermische nanopincetten, afgekort als CRONT.
In een nieuw rapport in Light:Science &Applications , bereikten Jiajie Chen en een onderzoeksteam op het gebied van opto-elektronica, biomedische technologie en natuurkunde dit door difusioforese en thermo-osmotische stromen te benutten voor optothermale excitatie door met succes DNA-gefunctionaliseerde gouden nanodeeltjes, CRISPR-geassocieerde eiwitten en DNA-strengen te verrijken.
De wetenschappers bouwden voort op een optothermisch schema om CRISPR-geassocieerde detectie van single-nucleotide polymorfisme op het niveau van één molecuul te verbeteren, om een nieuwe op CRISPR gebaseerde methode te introduceren om nucleotide-splitsing te observeren. De onderzoekers bestudeerden deze innovatieve aanpak als een universeel veld van point-of-care-diagnostiek, biofotonica en bionanotechnologie.
Optisch pincet
In 1986 vond Arthur Ashkin een optisch pincet uit om nano-objecten op afstand te reguleren en ontving in 2018 een Nobelprijs voor de natuurkunde voor deze baanbrekende ontdekking en bijdrage aan biologische systemen. Terwijl klassieke optische pincetten afhankelijk zijn van de momentumtransformatie van licht, hebben interdisciplinaire combinaties van plasmonische optica, elektrisch veld en temperatuur de grenzen effectief aangepakt.
Er is een verscheidenheid aan innovatieve benaderingen naar voren gekomen die nieuwe kansen bieden op het gebied van deeltjesanalyse en -regulering. Optothermische nanopincetten maken gebruik van optisch geïnduceerde thermodynamische krachten om nanodeeltjes op micronschaal te reguleren met sub-micronprecisie.
In vergelijking met traditionele optische pincetten vereisen optothermische pincetten een lagere vermogensdichtheid, waardoor ze een aantrekkelijk alternatief zijn voor biologische detectie, terwijl de nadelige optische effecten op biologische monsters worden verminderd. Omdat thermische effecten een sleutelrol spelen tijdens een verscheidenheid aan biologische processen, is het mogelijk om de mogelijkheden van het temperatuurveld te benutten voor praktische toepassingen.
De methode kan worden gebruikt om bionanodeeltjes te reguleren, variërend van micro- tot nanoschaal, inclusief bacteriën en levende cellen, evenals enkel- en dubbelstrengige DNA-moleculen en eiwitten.
CRISPR combineren met nanopincetten:CRONT
Het geclusterde CRISPR-systeem (Regelly Interspaced Short Palindrome Repeat) biedt zelf een opmerkelijk hulpmiddel voor het bewerken van genen, dat in 2020 ook een Nobelprijs ontving. De methode omvatte een CRISPR-geassocieerd nuclease-eiwit en een doel-DNA-specifiek gids-RNA.
Biofysici en bio-ingenieurs willen steeds meer de gevoeligheid en veelzijdigheid van DNA-detectie verbeteren door het CRISPR-Cas-systeem te combineren met nieuwe detectiemodi.
Om de bestaande beperkingen van de methode te overwinnen, ontwierpen Chen en collega's een universeel toepasbaar optothermisch pincetplatform, bekend als CRISPR-aangedreven optothermische nanotweezers, om bionanodeeltjes te identificeren en gebruikten ze de opstelling om in situ DNA-moleculen te identificeren, zonder nucleïnezuuramplificatie. De experimenten leverden ultralage detectievolumes van 10 μl op om polymorfismen van één nucleotide te identificeren en zo de genetische diversiteit, de vatbaarheid voor ziekten en de respons op geneesmiddelen te bestuderen, om zo te voldoen aan de toekomstige eisen van genomisch onderzoek en de geneeskunde.
Het werkingsprincipe
Om CRONT (CRISPR-aangedreven optothermale nanotweezers) mogelijk te maken, ontwierpen de wetenschappers een microfluïdische kamer met een dunne laag goudfilm afgezet op het dekglas. Toen het team de goudfilm bestraalde met laserverlichting, genereerden ze een temperatuurveld rondom de laservlek. De wetenschappers hebben de optimale omstandigheden voor CRISPR-reacties gedetailleerd beschreven en de splitsing van het DNA-goud-nanofilmconjugaat in gang gezet met behulp van donkerveldmicroscopie.
Ze voegden een niet-ionisch polymeer van polyethyleenglycol (PEG) toe aan de wateroplossing als biologische oppervlakteactieve stof voor uitstekende biocompatibiliteit.
De aanwezigheid van meerdere nanodeeltjes en hun variërende thermoforetische mobiliteit genereerden een duidelijke concentratie opgeloste stoffen. Toen opgeloste stoffen met verhoogde concentraties die met lagere concentraties beïnvloedden door osmotische druk, resulteerden de uitkomsten in een interactie die bekend staat als de diffusioforetische kracht. Dit systematische onderzoek benadrukte het potentieel voor CRONT om te worden opgenomen om biomoleculaire identificatie uit te voeren.
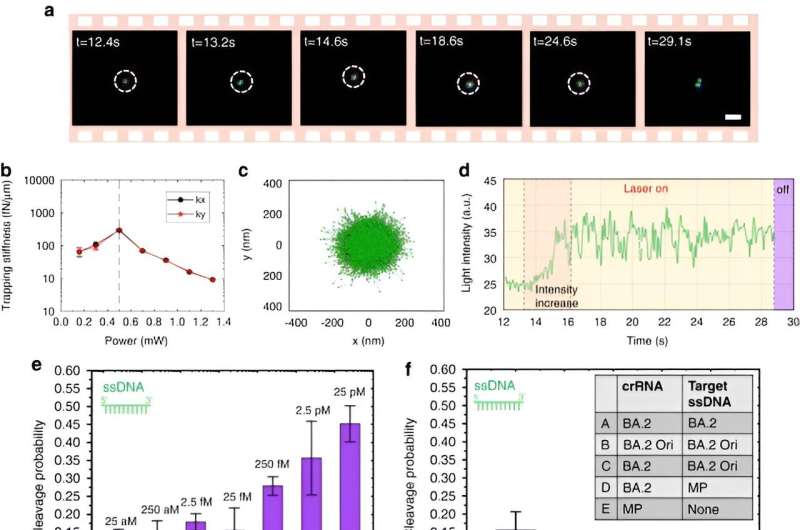
Optothermisch combineren van eiwitten en DNA's
Om CRISPR-aangedreven optothermische nanopincetten mogelijk te maken, bestudeerden Chen en collega's het aggregatiegedrag van eiwitten en DNA's door gebruik te maken van fluorescentielabeling waarbij de lengte van de stijve stengel een concentratiegradiënt van polyethyleenglycol genereerde. Hoewel een hoger laservermogen de accumulatiesnelheid niet continu verhoogde als gevolg van een vergrote thermo-osmotische stroom, was de accumulatie van enkelstrengs DNA hoger dan die van dubbelstrengs DNA. Hoewel eiwitophopingen zelden worden bestudeerd in de biofysica, vertoonden de fluorescentie-gelabelde Cas12a-eiwitten de neiging om lichte ringachtige ophopingen te vormen, waarbij het verhogen van het laservermogen hun accumulatiesnelheid verhoogde.
Het team voerde bovendien experimenten uit met algemeen opgenomen eiwitten zoals runderserumalbumine met FITC-labeling. In de aanwezigheid van een optothermisch veld bleef deze eiwitverdeling willekeurig en werd deze niet beïnvloed door de aanwezigheid van polyethyleenglycolmoleculen.
CRISPR-aangedreven optothermische nanopincet (CRONT) om nucleotiden te identificeren
Chen en team merkten op hoe het optothermische veld geassocieerd met de CRISPR-aangedreven optothermale nanotweezers (CRONT) een geschikte temperatuur opleverde voor op CRISPR gebaseerde biodetectie, met het vermogen om bionanodeeltjes te verrijken om DNA bij ultralage concentraties te detecteren, in plaats van alleen Brownse beweging. geregeld door de detectie van diffusie.
De wetenschappers gebruikten het CRISPR-12a-schema om enkelstrengig omgevings-DNA te onderzoeken. Het CRONT-systeem heeft met succes DNA's op het niveau van één molecuul geïdentificeerd voor polymorfismen met één nucleotide, met een hoge gevoeligheid en specificiteit.
Vooruitzichten
Op deze manier integreerden Jiajie Chen en collega's difusioforese en thermo-osmotische stromingen in de grenslaag van een optothermische responsieve film om een nieuwe methode te tonen om CRISPR-aangedreven optothermische nanopincetten op nanoschaal te reguleren.
Deze methode maakte de onmiddellijke implementatie van op CRISPR gebaseerde biosensoren met een ultralaag detectievolume mogelijk.
Optische pincetten zijn voorzien van DNA-identificatie via op CRISPR gebaseerde biosensorsystemen als een manier voor verrijking van biomoleculen om het CRISPR-complex te splitsen. Dergelijke CRISPR-aangedreven optothermische nanopincetten of CRONT-systemen houden een enorme belofte in om het begrip van complexe biologische processen te bevorderen als een veelzijdige detectiesonde in biomedisch onderzoek, medicijnontdekking en ziektediagnostiek.
Meer informatie: Jiajie Chen et al, CRISPR-aangedreven optothermische nanopincetten:diverse manipulatie van bio-nanodeeltjes en identificatie van afzonderlijke nucleotiden, Licht:wetenschap en toepassingen (2023). DOI:10.1038/s41377-023-01326-9
Journaalinformatie: Licht:wetenschap en toepassingen
© 2023 Science X Netwerk
 De magische boom van Latijns-Amerika komt langzaam weer tot leven
De magische boom van Latijns-Amerika komt langzaam weer tot leven Hoe veehouders in Brazilië de CO2-uitstoot kunnen helpen verminderen
Hoe veehouders in Brazilië de CO2-uitstoot kunnen helpen verminderen Trump-regering wil terugdraaien van regels voor brandstofefficiëntie uit het Obama-tijdperk
Trump-regering wil terugdraaien van regels voor brandstofefficiëntie uit het Obama-tijdperk Dieren die afhankelijk zijn van Tides for Survival
Dieren die afhankelijk zijn van Tides for Survival  Is toenemend kunstlicht 's nachts een gevaar voor koraalriffen?
Is toenemend kunstlicht 's nachts een gevaar voor koraalriffen?
Hoofdlijnen
- Hoe je de aantallen zwerfkatten terugdringt op een manier die voor iedereen beter werkt
- 10 manieren waarop gegevens werden gebruikt om ziekten te bestrijden
- Wat maakt de aarde precies goed voor leven?
- Kan een naaimachine DNA aan elkaar naaien?
- De effectiviteit van camouflage bij verschillende dieren vergelijken
- Onthult dit dinosauruskerkhof hun laatste dag op aarde? Een expert onderzoekt het bewijs
- Netwerkvirusdetectoren die mensen kunnen beschermen tegen dierlijke ziekteverwekkers
- Hoe orang-oetanmoeders hun kroost helpen bij het leren
- Onderzoekers gebruiken modelleringstools voor machinaal leren om de technologie voor het bewerken van zinkvingernucleases te verbeteren
- Doorbraak in gedrukte elektronica kan leiden tot flexibele elektronicarevolutie

- Nanodeeltjes kunnen kubisch groeien
- Zrommen microrobots kunnen een oplossing zijn voor het deblokkeren van medische apparaten in het lichaam

- Gepatenteerde techniek sleutel tot nieuwe zonne-energietechnologie

- Alles ingepakt:grafeenmantel van onderzoekers beschermt bacteriën
 Gebruik van geradicaliseerde NOₓ-derivaten op metaaloxiden
Gebruik van geradicaliseerde NOₓ-derivaten op metaaloxiden Een hobbel op een perceel van het Chandra-röntgenobservatorium onthult een overmaat aan röntgenstralen, hint naar donkere materie
Een hobbel op een perceel van het Chandra-röntgenobservatorium onthult een overmaat aan röntgenstralen, hint naar donkere materie Quibi lanceert Hollywood voor onderweg streaming tijdens lockdown
Quibi lanceert Hollywood voor onderweg streaming tijdens lockdown Hoe maak je een Super Magnet
Hoe maak je een Super Magnet Waarom zoveel middeleeuwse manuscripten doodles bevatten. En wat ze onthullen
Waarom zoveel middeleeuwse manuscripten doodles bevatten. En wat ze onthullen Wat is een rivieroverstroming?
Wat is een rivieroverstroming?  Hoe treinongevallen met gevaarlijke stoffen de waarde van eigendommen van mensen beïnvloeden
Hoe treinongevallen met gevaarlijke stoffen de waarde van eigendommen van mensen beïnvloeden De nullen van een functie vinden
De nullen van een functie vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

