
Wetenschap
Nanodeeltjes infiltreren, kankercellen van binnenuit doden
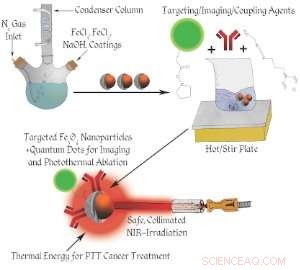
Schema van de constructie van nanodeeltjes.
Conventionele behandeling is gericht op het uitroeien van kankercellen door medicijnen en therapie die van buiten de cel worden toegediend, die ook nabijgelegen normale cellen kunnen aantasten (en mogelijk schade kunnen toebrengen).
In tegenstelling tot conventionele kankertherapie, een team van de Universiteit van Cincinnati heeft verschillende nieuwe ontwerpen ontwikkeld voor op ijzeroxide gebaseerde nanodeeltjes die detecteren, kankercellen diagnosticeren en vernietigen met behulp van fotothermische therapie (PTT). PTT gebruikt de nanodeeltjes om door licht geïnduceerde warmte-energie alleen in de tumor te concentreren, geen aangrenzende normale cellen beschadigen.
De resultaten van het UC-werk zullen worden gepresenteerd op de Materials Research Society-conferentie in Boston van 30 november tot en met december. 5 door Andrew Dunn, doctoraatsstudent in materiaalkunde aan het UC's College of Engineering and Applied Science. Samen met Dunn in dit onderzoek werken Donglu Shi, hoogleraar materiaalkunde aan het UC's College of Engineering and Applied Science; David Mast, universitair hoofddocent natuurkunde aan het McMicken College of Arts and Sciences van de UC; en Giovanni Pauletti, universitair hoofddocent aan het James L. Winkle College of Pharmacy.
De UC-studie gebruikte de levende cellen van muizen om met succes de werkzaamheid te testen van hun tweezijdige nanodeeltjesontwerpen (de ene kant voor celtargeting en de andere voor behandelingsafgifte) in combinatie met de PTT. Echter, de Amerikaanse Food and Drug Administration heeft nu het gebruik van ijzeroxide-nanodeeltjes bij mensen goedgekeurd. Dat betekent dat het fotothermische effect van ijzeroxide-nanodeeltjes kan aantonen, in het volgende decennium, een sterke belofte in de behandeling van kanker bij mensen, waarschijnlijk met gelokaliseerde tumoren.
Hoe de nanodeeltjes werken met fotothermische therapie
Met deze technologie, een laserstraal met laag vermogen wordt gericht op de tumor waar een kleine hoeveelheid magnetische ijzeroxide-nanodeeltjes aanwezig is, ofwel door de deeltjes rechtstreeks in de tumor te injecteren of ze in de bloedstroom te injecteren, waarbij de deeltjes de abnormale kankercellen vinden en eraan binden via celspecifieke targeting.
Lokaal wordt dan voldoende warmte opgewekt door het laserlicht, de tumortemperatuur snel verhogen tot boven de 43 graden Celsius, en daardoor de abnormale kankercellen verbranden. Deze specifieke PTT-behandeling omvat geen medicijnen, maar genereert alleen lokale warmte in de tumor, daarom veel minder bijwerkingen dan de traditionele chemo- of bestralingstherapieën.
"Deze behandeling is veel ideaaler omdat het rechtstreeks naar de kankercel gaat, " zegt Shi. "De nanomaterialen komen alleen de abnormale cellen binnen, die cellen verlichten en dan doen waarvoor je ze hebt ontworpen. In dit geval, het is om heet genoeg op te warmen om de kankercellen te verbranden en te doden, maar geen schade toebrengen aan de omringende normale cellen."
Shi voegde eraan toe dat artsen vaak gefrustreerd zijn over de huidige conventionele middelen voor vroege beeldvorming van kankercellen door middel van medische resonantiebeeldvorming of geautomatiseerde tomografiescans, omdat de tumoren meestal stadium drie of vier zijn voordat ze kunnen worden gedetecteerd. Hij beweerde, "Met nanomateriaaltechnologie we kunnen de tumor vroeg detecteren en hem tegelijkertijd op zicht doden."
Celtargeting
Elke tumor heeft een corresponderend eiwit dat kankerspecifiek is, een tumorspecifiek ligand genoemd of een antilichaamantigeenreactie die alleen expressie heeft voor die specifieke kanker zoals borst- of prostaatkanker.
Wetenschappers identificeren deze bepaalde biomarker die specifiek is voor een bepaalde tumor, vervolgens conjugeert deze biomarker op het oppervlak van de nanodrager die alleen de uitdrukking heeft voor dat specifieke soort kankercel.
Het richt zich dan alleen op de abnormale kankercel, niet normaal, gezonde cellen, en omdat het zo klein is, kan het het membraan breken en die geconjugeerde kankercel binnendringen en de PTT vrijgeven.
De nanotech-dragers gaan het lichaam binnen via een ader in de bloedbaan, zoek de abnormale kankercellen, vind de biomarker of kankercellen en hecht aan die cellen en ontgrendel hun fluorescerende deeltjes zodat ze kunnen worden gedetecteerd door een fotonenlaserlicht.
Het laserlicht verwarmt de nanodeeltjes tot minstens 43 graden Celsius om de kankercellen te doden, uiteindelijk blijven alle andere cellen in het lichaam ongedeerd.
Potentiële doe-het-zelf kankerbehandeling
De procedure kan uiteindelijk worden uitgevoerd door de patiënt na een training om twee tot drie keer per dag gedurende een bepaalde tijd een klein laserlichtapparaat op het getroffen gebied te richten. Deze methode kan uiteindelijk het slagingspercentage verbeteren, en kosten voor de patiënt te besparen. Dit geeft "richten en schieten" een geheel nieuwe betekenis.
Toekomstig onderzoek naar nanodeeltjes PTT zal kijken naar toxiciteit, problemen met biologische afbreekbaarheid en compatibiliteit. Shi zei dat het team momenteel op zoek is naar andere diverse biologisch afbreekbare materialen om te gebruiken voor de dragers, zoals chlorofylen van planten zoals die in kool die zowel eetbaar als fotothermisch zijn. Dit materiaal is biocompatibel en biologisch afbreekbaar en kan mogelijk in de tumorcellen blijven totdat zijn werk is voltooid, dan oplossen en worden doorgegeven via het spijsverteringsstelsel.
 Biobased chemicaliën staan centraal
Biobased chemicaliën staan centraal De sleutel tot het verminderen van de uitstoot van kooldioxide is gemaakt van metaal
De sleutel tot het verminderen van de uitstoot van kooldioxide is gemaakt van metaal Nieuwe tool maakt beeldvorming van neurale activiteit mogelijk met nabij-infrarood licht
Nieuwe tool maakt beeldvorming van neurale activiteit mogelijk met nabij-infrarood licht de tijdloze, complementaire smaak van oesters en champagne - uitgelegd
de tijdloze, complementaire smaak van oesters en champagne - uitgelegd Van hard naar zacht:sponzen maken van mosselschelpen
Van hard naar zacht:sponzen maken van mosselschelpen
 Technische oplossingen ontdekken voor een koolstofarme toekomst:afvang en opslag van koolstof
Technische oplossingen ontdekken voor een koolstofarme toekomst:afvang en opslag van koolstof NASA tropische storm Erick versterkt
NASA tropische storm Erick versterkt Het belang van het bospecosysteem
Het belang van het bospecosysteem Computermodel lost mysterie op over hoe gasbellen grote methaanhydraatafzettingen vormen
Computermodel lost mysterie op over hoe gasbellen grote methaanhydraatafzettingen vormen Half miljoen krabben gedood door plastic afval op afgelegen eilanden
Half miljoen krabben gedood door plastic afval op afgelegen eilanden
Hoofdlijnen
- Welke moleculen kunnen zonder hulp door het plasmamembraan gaan?
- 'S Werelds botanische tuinen bevatten een derde van alle bekende plantensoorten, en help de meest bedreigde te beschermen
- Waar vindt ademhaling plaats?
- Feiten over de wortelcellen van planten
- 10 slechtste aanpassingen in het dierenrijk
- Zeldzame vliegende vossen neergeschoten bij gruwelijke aanval in Australië
- Hoe regelt het lichaam de hartslag?
- De centrale hoek vinden
- De twee soorten exocriene secretoire cellen in de maag
- Licht op maat maken met 2D-materialen

- Nieuwe Nano3-microscoop maakt het mogelijk om met hoge resolutie in cellen te kijken

- Hoe fulleriet harder wordt dan diamant

- Spontane vorming van holle structuren op nanoschaal zou de batterijopslag kunnen vergroten

- Verbeterde lichtoogst in quantum dot-metal-organic frameworks
 Hoe te stoppen LED-lampjes knipperen te snel
Hoe te stoppen LED-lampjes knipperen te snel  Kunnen schimmels de modewereld redden?
Kunnen schimmels de modewereld redden? Nieuw rapport onthult verborgen complexiteiten van verhoging voor claimanten van Universal Credit
Nieuw rapport onthult verborgen complexiteiten van verhoging voor claimanten van Universal Credit Tiener klimaatactivist tegen Franse critici:luister naar de wetenschap
Tiener klimaatactivist tegen Franse critici:luister naar de wetenschap Canarische Eilanden geselecteerd als alternatieve locatie voor gigantische telescoop
Canarische Eilanden geselecteerd als alternatieve locatie voor gigantische telescoop Skyfall:weer een budgetluchtvaartmaatschappij gaat ten onder door worsteling in de sector
Skyfall:weer een budgetluchtvaartmaatschappij gaat ten onder door worsteling in de sector Ontwikkeling bedreigt tropische bossen, onderzoekers zeggen:
Ontwikkeling bedreigt tropische bossen, onderzoekers zeggen: Nieuwe infraroodbeeldvormingstechniek onthult moleculaire oriëntatie van eiwitten in zijdevezels
Nieuwe infraroodbeeldvormingstechniek onthult moleculaire oriëntatie van eiwitten in zijdevezels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

