
Wetenschap
Nieuwe 3D-beeldvormingstechnologie maakt fluorescentiemicroscopie efficiënter

Dr. Kevin Tsia (1e van rechts) en zijn team ontwikkelden een nieuwe optische beeldvormingstechnologie om 3D-fluorescentiemicroscopie efficiënter en minder schadelijk te maken. (Van links:Dr. Yuxuan Ren, Dr. Queenie Lai en Dr. Kevin Tsia) Credit:@The University of Hong Kong
Wetenschappers gebruiken al tientallen jaren fluorescentiemicroscopie om de interne werking van biologische cellen en organismen te bestuderen. Echter, veel van deze platforms zijn vaak te traag om de biologische actie in 3D te volgen; en te schadelijk voor de levende biologische exemplaren met sterke lichtverlichting.
Om deze uitdagingen aan te gaan, een onderzoeksteam onder leiding van Dr. Kevin Tsia, Universitair hoofddocent van de afdeling Electrical and Electronic Engineering en programmadirecteur Bachelor of Engineering in Biomedical Engineering van de University of Hong Kong (HKU), een nieuwe optische beeldvormingstechnologie ontwikkeld - gecodeerde light-sheet array microscopie (CLAM) - die 3D-beeldvorming met hoge snelheid kan uitvoeren, en is energiezuinig en zacht genoeg om levende exemplaren tijdens het scannen te behouden op een niveau dat niet wordt bereikt door bestaande technologieën.
Deze geavanceerde beeldtechnologie is onlangs gepubliceerd in Licht:wetenschap en toepassingen . Voor de innovatie is een Amerikaanse octrooiaanvraag ingediend.
"CLAM maakt 3D-fluorescentiebeeldvorming mogelijk met een hoge framesnelheid vergelijkbaar met state-of-the-art technologie (~ 10's volumes per seconde). Wat nog belangrijker is, het is veel energiezuiniger, meer dan 1 zijn 000 keer zachter dan de standaard 3D-microscopen die veel worden gebruikt in wetenschappelijke laboratoria, die de schade aan levende exemplaren tijdens het scannen aanzienlijk vermindert, " legde Dr. Tsia uit.
Bestaande 3D-biologische microscopieplatforms zijn traag omdat het volledige volume van het monster achtereenvolgens moet worden gescand en punt voor punt moet worden afgebeeld, lijn voor lijn of vliegtuig voor vliegtuig. Op deze platformen een enkele 3D-snapshot vereist herhaalde verlichting op het monster. De exemplaren worden vaak met duizenden tot miljoenen keren meer intensiteit verlicht dan die van zonlicht. Dit zal waarschijnlijk het monster zelf beschadigen, is dus niet gunstig voor biologische beeldvorming op lange termijn voor diverse toepassingen zoals anatomische wetenschap, ontwikkelingsbiologie en neurowetenschappen.
Bovendien, deze platforms putten vaak het beperkte fluorescentie-"budget" snel uit - een fundamentele beperking dat fluorescerend licht alleen kan worden gegenereerd bij verlichting gedurende een beperkte periode voordat het permanent vervaagt in een proces dat "fotobleken" wordt genoemd, " die een limiet stelt aan het aantal beeldacquisities dat op een monster kan worden uitgevoerd.

Coded Light-sheet Array Microscopy (CLAM) Credit:@The University of Hong Kong
"Herhaalde verlichting op het monster versnelt niet alleen het fotobleken, maar genereert ook overmatig fluorescentielicht dat uiteindelijk niet het uiteindelijke beeld vormt. Vandaar, het fluorescentie-'budget' wordt grotendeels verspild in deze beeldvormingsplatforms, "Dr. Tsia voegde eraan toe.
Het hart van CLAM is het transformeren van een enkele laserstraal in een array van 'light-sheets' met hoge dichtheid met behulp van een paar parallelle spiegels, te verspreiden over een groot gebied van het monster als fluorescentie-excitatie.
"Het beeld binnen het gehele 3D-volume wordt tegelijkertijd vastgelegd (d.w.z. geparalleliseerd), zonder de noodzaak om het monster punt voor punt of lijn voor lijn of vlak voor vliegtuig te scannen, zoals vereist door andere technieken. Dergelijke 3D-parallellisatie in CLAM leidt tot een zeer zachte en efficiënte 3D-fluorescentiebeeldvorming zonder in te boeten aan gevoeligheid en snelheid, " zoals opgemerkt door Dr. Yuxuan Ren, een postdoctoraal onderzoeker over het werk. CLAM presteert ook beter dan de gebruikelijke 3D-fluorescentiebeeldvormingsmethoden bij het verminderen van het effect van fotobleken.
Om de beeldresolutie en kwaliteit in CLAM te behouden, het team wendde zich tot Code Division Multiplexing (CDM), een beeldcoderingstechniek die veel wordt gebruikt in de telecommunicatie voor het gelijktijdig verzenden van meerdere signalen.
"Deze coderingstechniek stelt ons in staat om een 2D-beeldsensor te gebruiken om alle beeldstapels tegelijkertijd in 3D vast te leggen en digitaal te reconstrueren. CDM is nog nooit eerder gebruikt in 3D-beeldvorming. We hebben de technologie overgenomen, wat een succes werd, " uitgelegd door Dr. Queenie Lai, een andere postdoctoraal onderzoeker die het systeem heeft ontwikkeld.
Als proof-of-concept demonstratie, het team paste CLAM toe om 3D-video's van snelle microdeeltjesstroom vast te leggen in een microfluïdische chip met een volumesnelheid van meer dan 10 volumes per seconde vergelijkbaar met de modernste technologie.
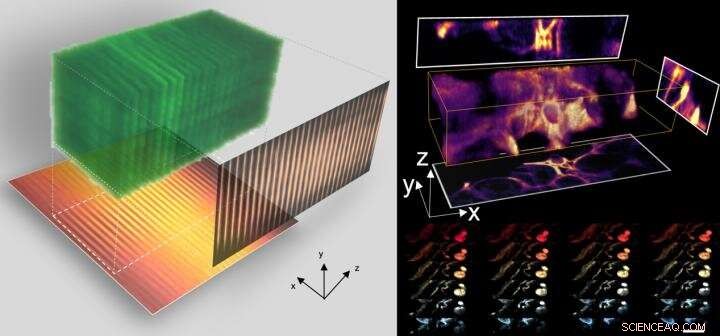
3D-beeldvorming op hoge snelheid met CLAM. Krediet:de universiteit van Hong Kong
"CLAM heeft geen fundamentele beperking in beeldsnelheid. De enige beperking is de snelheid van de detector die in het systeem wordt gebruikt, d.w.z. de camera voor het maken van snapshots. Naarmate de technologie voor hogesnelheidscamera's voortdurend wordt verbeterd, CLAM kan altijd zijn limiet uitdagen om een nog hogere scansnelheid te bereiken, " benadrukt door Dr. Jianglai Wu, het postdoctoraal onderzoek dat het werk heeft geïnitieerd.
Het team is een stap verder gegaan door CLAM te combineren met de nieuw ontwikkelde weefselzuiveringstechnologie van de HKU LKS Faculty of Medicine om 3D-visualisatie van muisglomeruli en darmbloedvaten in hoge framesnelheid uit te voeren.
"We verwachten dat deze gecombineerde techniek kan worden uitgebreid tot grootschalig 3-D histopathologisch onderzoek van biologische archiefmonsters, zoals het in kaart brengen van de cellulaire organisatie in de hersenen voor neurowetenschappelijk onderzoek," zei Dr. Tsia.
"Aangezien CLAM-beeldvorming aanzienlijk zachter is dan alle andere methoden, het is een unieke voorstander van langdurige en continue 'surveillance' van biologische exemplaren in hun levende vorm. Dit kan mogelijk van invloed zijn op ons fundamentele begrip in veel aspecten van celbiologie, bijv. om continu te volgen hoe een dierlijk embryo zich ontwikkelt tot zijn volwassen vorm; om in realtime te volgen hoe de cellen/organismen worden geïnfecteerd door bacteriën of virussen; om te zien hoe de kankercellen worden gedood door medicijnen, en andere uitdagende taken die tegenwoordig niet haalbaar zijn met bestaande technologieën, "Dr. Tsia voegde eraan toe.
CLAM kan worden aangepast aan veel huidige microscoopsystemen met minimale hardware- of softwareaanpassing. Hiervan profiteren, het team is van plan om het huidige CLAM-systeem verder te upgraden voor onderzoek in celbiologie, ontwikkelingsbiologie van dieren en planten.
 Onderzoekers koppelen weesreceptor aan opioïde-geïnduceerde jeuk
Onderzoekers koppelen weesreceptor aan opioïde-geïnduceerde jeuk Hoe maak je een Molecule School Project
Hoe maak je een Molecule School Project Nieuw ontwikkelde molecule om geneesmiddelen te verbeteren, haalt inspiratie uit de gereedschapskist van de natuur
Nieuw ontwikkelde molecule om geneesmiddelen te verbeteren, haalt inspiratie uit de gereedschapskist van de natuur Ongeneeslijke ziekten krijgen een nieuw hulpmiddel voor het ontdekken van RNA-geneesmiddelen
Ongeneeslijke ziekten krijgen een nieuw hulpmiddel voor het ontdekken van RNA-geneesmiddelen Biologische medicijnen maken met spinnenzijde-eiwit
Biologische medicijnen maken met spinnenzijde-eiwit
 Amazon-vooruitzichten - aanhoudende opwarming, meerjarige droogte
Amazon-vooruitzichten - aanhoudende opwarming, meerjarige droogte Hulpmiddelen voor het meten van abiotische ecologische factoren
Hulpmiddelen voor het meten van abiotische ecologische factoren Meteorologen verbeteren multivariabele geïntegreerde evaluatiemethode voor klimaatmodel
Meteorologen verbeteren multivariabele geïntegreerde evaluatiemethode voor klimaatmodel Studie:opwarming maakt megadroogte in het westen van de VS de ergste in de moderne tijd
Studie:opwarming maakt megadroogte in het westen van de VS de ergste in de moderne tijd Hoe de duisternis en de kou de dinosaurussen hebben gedood
Hoe de duisternis en de kou de dinosaurussen hebben gedood
Hoofdlijnen
- Meer wolfachtig worden is de sleutel tot de toekomst voor coyotes
- Vergeten is niet altijd slecht - het helpt ons betere beslissingen te nemen
- Bacteriën kunnen antibioticaresistentie via de bodem verspreiden
- Hoe werkt ATP?
- Welke soorten organische moleculen vormen een celmembraan?
- Net als mensen, honden bleken onrustig te slapen na negatieve ervaringen
- Pizza-nachtmerries:kan uw dieet uw dromen bepalen?
- Hoe BRCA-genen werken
- Wat zijn de functies van koolhydraten in planten en dieren?
- Hoe maak je plastic tandwielen
- Een elektrisch gepompte oppervlakte-emitterende groene halfgeleiderlaser
- De zoektocht naar elektronengatvloeistoffen wordt warmer
- Onderzoekers onderzoeken waarom kleding niet uit elkaar valt

- Wetenschappers observeren voor het eerst een nieuw type topologisch defect in chirale magneten

 Wetenschappers vinden antarctische microben die alleen van lucht leven
Wetenschappers vinden antarctische microben die alleen van lucht leven  Hoe Grams te converteren naar Ounces voor Goud & Zilver
Hoe Grams te converteren naar Ounces voor Goud & Zilver  Wat zijn de aanpassingen voor overleving voor zeegras?
Wat zijn de aanpassingen voor overleving voor zeegras?  Luchtkwaliteit op kantoor kan de cognitie van medewerkers beïnvloeden, productiviteit
Luchtkwaliteit op kantoor kan de cognitie van medewerkers beïnvloeden, productiviteit Taal is belangrijk wanneer de aarde zich midden in een klimaatcrisis bevindt
Taal is belangrijk wanneer de aarde zich midden in een klimaatcrisis bevindt Nieuwe lensloze camera maakt gedetailleerde 3D-beelden zonder te scannen
Nieuwe lensloze camera maakt gedetailleerde 3D-beelden zonder te scannen De herinnering aan gletsjers bewaren
De herinnering aan gletsjers bewaren Ierlands eerste gras-gevoede bioraffinaderij gaat de weg op om boeren te helpen groen te worden
Ierlands eerste gras-gevoede bioraffinaderij gaat de weg op om boeren te helpen groen te worden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

