
Wetenschap
Hoe bewegen moleculen binnen een vaste vloeistof en gas?
vaste stoffen
* strak verpakt: Moleculen in vaste stoffen zijn zeer dicht bij elkaar, gehouden in een rigide, vaste structuur door sterke intermoleculaire krachten.
* trillingen: De moleculen trillen voornamelijk op zijn plaats, met beperkte beweging. Ze oscilleren heen en weer rond hun vaste posities.
* Lage kinetische energie: Vaste stoffen hebben de laagste kinetische energie van de drie staten van materie.
* Definitieve vorm en volume: De rigide structuur geeft vaste stoffen een vaste vorm en volume.
vloeistoffen
* minder strak verpakt: Moleculen in vloeistoffen zijn dichter bij elkaar dan in gassen, maar hebben meer vrijheid om te bewegen dan in vaste stoffen. De intermoleculaire krachten zijn zwakker dan in vaste stoffen.
* vloeistofbeweging: Moleculen kunnen langs elkaar glijden, waardoor vloeistoffen kunnen stromen en de vorm van hun container kunnen aannemen.
* Matige kinetische energie: Vloeistoffen hebben meer kinetische energie dan vaste stoffen, waardoor een grotere beweging mogelijk is.
* definitief volume, onbepaalde vorm: Vloeistoffen behouden een constant volume, maar hun vorm past zich aan de container aan.
gassen
* wijd verdeeld: Moleculen in gassen zijn ver uit elkaar en hebben zwakke intermoleculaire krachten.
* willekeurige beweging: Gasmoleculen bewegen snel in alle richtingen, botsen met elkaar en de wanden van hun container.
* Hoge kinetische energie: Gassen hebben de hoogste kinetische energie van de drie staten van materie.
* onbepaalde vorm en volume: Gassen vullen het hele volume van hun container en nemen de vorm van de container aan.
illustratieve analogie
Stel je een dansvloer voor:
* solide: Mensen zijn strak verpakt, nauwelijks bewegend, gewoon op zijn plaats zwaaien (trillingen).
* vloeistof: Mensen zijn een beetje meer verspreid en kunnen zich bewegen, tegen elkaar botsen (glijdende beweging).
* gas: Mensen zijn verspreid en beweegt zich vrij, botsen tegen elkaar en de muren van de dansvloer (willekeurige beweging).
Key Concepts:
* Kinetische energie: De energie van beweging. Hoe hoger de kinetische energie, hoe sneller de moleculen bewegen.
* intermoleculaire krachten: De krachten van aantrekkingskracht tussen moleculen. Sterkere krachten leiden tot meer beperkte beweging.
* Temperatuur: Naarmate de temperatuur toeneemt, krijgen moleculen kinetische energie en bewegen ze sneller.
Laat het me weten als je op een van deze punten meer details wilt!
 Welke hebben hogere kookpunten organische of anorganische verbindingen?
Welke hebben hogere kookpunten organische of anorganische verbindingen?  Bij welk proces van planten komt waterdamp vrij in de lucht?
Bij welk proces van planten komt waterdamp vrij in de lucht?  Theoretisch percentage berekenen
Theoretisch percentage berekenen Wat is er mis met de volgende naam:2, Methyl Pentane?
Wat is er mis met de volgende naam:2, Methyl Pentane?  De toekomst van op halfgeleiders gebaseerde fotokatalytische processen opfleuren
De toekomst van op halfgeleiders gebaseerde fotokatalytische processen opfleuren
 Hoe zonering de uitstoot van broeikasgassen beïnvloedt
Hoe zonering de uitstoot van broeikasgassen beïnvloedt  Koraalverlies op Palmeilanden gaat lang vooraf aan massaverbleking in 2016 op Great Barrier Reef
Koraalverlies op Palmeilanden gaat lang vooraf aan massaverbleking in 2016 op Great Barrier Reef Klimaatverandering vertraagt de Atlantische stromingen die Europa en de Atlantische kust verwarmen
Klimaatverandering vertraagt de Atlantische stromingen die Europa en de Atlantische kust verwarmen India bereidt zich voor op extreem zware cycloon Golf van Bengalen
India bereidt zich voor op extreem zware cycloon Golf van Bengalen Het tweesnijdende zwaard van palmolie
Het tweesnijdende zwaard van palmolie
Hoofdlijnen
- Onderzoek toont aan hoe embryonale stamcellen de menselijke ontwikkeling orkestreren
- Wat gebeurt er wanneer cellen zich verdelen om twee nieuwe kernen te vormen die identiek zijn aan elkaar?
- Onderzoekers identificeren Ku-eiwitten als nieuwe co-sensoren van cyclische GMP-AMP-synthase
- Wat is het doel van het kopiëren van DNA?
- Hoe de lengte van DNA-fragmenten
- Waarom zijn er extra onderdelen in een plantencel?
- Welke twee dingen heeft elke villus?
- Hoe verhoudt organen zich tot cellen en orgaansysteem?
- Wat zijn drie primaire doelen van mitose?
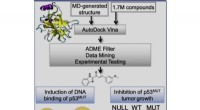
- Nieuwe studie onthult computergestuurde benadering voor het onderdrukken van kankertumorgroei
- Wetenschappers zetten plastic om in bruikbare chemicaliën met behulp van zonlicht

- Onderzoekers rapporteren eerste 3D-structuur van DHHC-enzymen
- Echografie kan sterkere 3D-geprinte legeringen maken

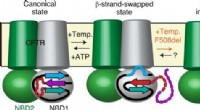
- Uiterlijk van cystische fibrose op moleculaire schaal
 Twee zeldzame aanvallen van zeeleeuwen sluiten baai in San Francisco Bay af
Twee zeldzame aanvallen van zeeleeuwen sluiten baai in San Francisco Bay af Wat elk land wel en niet kan doen op Antarctica, de naam van wetenschap
Wat elk land wel en niet kan doen op Antarctica, de naam van wetenschap  Hoeveel verdient een boer voor een windturbine?
Hoeveel verdient een boer voor een windturbine?  Total start productie bij Franse biobrandstofraffinaderij
Total start productie bij Franse biobrandstofraffinaderij Wetenschappers ontdekken wat het hemelse fenomeen STEVE aandrijft
Wetenschappers ontdekken wat het hemelse fenomeen STEVE aandrijft  In 2024 zal er een nieuwe 'gastster' aan de hemel verschijnen - een ruimtewetenschapper legt uit hoe nova-gebeurtenissen werken en waar je moet kijken
In 2024 zal er een nieuwe 'gastster' aan de hemel verschijnen - een ruimtewetenschapper legt uit hoe nova-gebeurtenissen werken en waar je moet kijken  Hoe houdt de zwaartekracht de aarde in een baan om de zon?
Hoe houdt de zwaartekracht de aarde in een baan om de zon?  Vier grote groepen organische verbindingen die levende organismen samenstellen
Vier grote groepen organische verbindingen die levende organismen samenstellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

