
Wetenschap
Welke hebben hogere kookpunten organische of anorganische verbindingen?
Factoren die het kookpunt beïnvloeden:
* intermoleculaire krachten: Deze krachten houden moleculen bij elkaar. Sterkere intermoleculaire krachten vereisen meer energie om te breken, wat resulteert in hogere kookpunten.
* Molecuulgewicht: Grotere moleculen hebben over het algemeen hogere kookpunten omdat ze meer elektronen en een groter oppervlak hebben, wat leidt tot sterkere dispersiekrachten in Londen.
* Moleculaire vorm: Lineaire moleculen hebben meestal hogere kookpunten dan vertakte moleculen vanwege een groter oppervlak voor interactie.
* waterstofbinding: Dit is een bijzonder sterke intermoleculaire kracht die optreedt wanneer een waterstofatoom wordt gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor). Verbindingen die waterstofbinding kunnen hebben, hebben aanzienlijk hogere kookpunten.
Algemene trends:
* anorganische verbindingen: Veel anorganische verbindingen hebben hoge kookpunten Vanwege sterke ionische bindingen of netwerkcovalente structuren. Voorbeelden zijn zouten zoals NaCl en netwerk vaste stoffen zoals Diamond.
* Organische verbindingen: Organische verbindingen hebben over het algemeen lagere kookpunten dan anorganische verbindingen, vaak als gevolg van zwakkere intermoleculaire krachten (zoals dispersiekrachten in Londen of dipool-dipool interacties). Organische verbindingen die in staat zijn tot waterstofbinding (zoals alcoholen, carbonzuren en amiden) kunnen echter relatief hoge kookpunten hebben.
Uitzonderingen:
* Grote organische moleculen: Organische polymeren (zoals polyethyleen) kunnen uitzonderlijk hoge kookpunten hebben vanwege hun massale molecuulgewicht en potentieel voor sterke intermoleculaire interacties.
* Kleine anorganische verbindingen: Sommige kleine anorganische verbindingen, zoals methaan (CH4) en ammoniak (NH3), hebben relatief lage kookpunten als gevolg van zwakke intermoleculaire krachten.
Conclusie:
Het is geen eenvoudige "organische versus anorganische" vergelijking. Zowel organische als anorganische verbindingen kunnen hoge of lage kookpunten hebben, afhankelijk van het specifieke molecuul en zijn intermoleculaire krachten. Om te bepalen welke verbinding een hoger kookpunt heeft, moet u rekening houden met de specifieke chemische structuren en eigenschappen van elke verbinding.
 6 grafieken om klimaatverandering te verklaren
6 grafieken om klimaatverandering te verklaren regeringen, onderzoekers onderschatten impact van inefficiënt landgebruik op klimaatverandering
regeringen, onderzoekers onderschatten impact van inefficiënt landgebruik op klimaatverandering Het ontrafelen van de complexiteit van luchtvervuiling in de koudste hoofdstad ter wereld
Het ontrafelen van de complexiteit van luchtvervuiling in de koudste hoofdstad ter wereld Technologie verandert algen van gemeentelijk afvalwater in speciale chemicaliën voor biobrandstoffen, bioplastics
Technologie verandert algen van gemeentelijk afvalwater in speciale chemicaliën voor biobrandstoffen, bioplastics Oude boom onthult oorzaak van piek in Arctische temperatuur
Oude boom onthult oorzaak van piek in Arctische temperatuur
Hoofdlijnen
- Welke drie woorden gebruik je voor de hypothese?
- Soorten redeneren in geometrie
- Microbeads zorgen ervoor dat ultrasone golven cellen veiliger kunnen stimuleren
- Herintroductie van bizons in graslanden vergroot de plantendiversiteit, droogtebestendigheid, studievondsten
- Wat is een niet-epitheelcel?
- Welke soorten organismen bevatten chlorofyl?
- Onderzoekers stellen vast dat jaarlijks grote aantallen wilde berggeiten door lawines worden gedood
- Een betere manier om pesticiden van appels te wassen
- Wat zijn de verschillen tussen een CZS en een PNS?
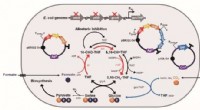
- Gemanipuleerde E. coli met mierenzuur en CO2 als een C1-raffinaderijplatformstam
- Bevroren koper gedraagt zich als edelmetaal in katalyse:studie

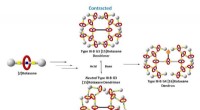
- Doorbraak in macromoleculaire machines voor actief gecontroleerde toediening van kankergeneesmiddelen
- Schimmel als geluidsabsorbeerder

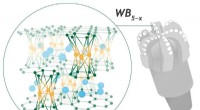
- Onderzoekers lossen 60 jaar oude puzzel op over superhard materiaal
 Synthetische moleculaire codes programmeren om genen aan te zetten
Synthetische moleculaire codes programmeren om genen aan te zetten Het grote geld gaat de wereld rond
Het grote geld gaat de wereld rond Definitie van opvolger en voorganger in wiskunde
Definitie van opvolger en voorganger in wiskunde  Onderzoek toont aan hoe klimaatverandering de gezondheid bedreigt
Onderzoek toont aan hoe klimaatverandering de gezondheid bedreigt  Wat is de samenstelling van een lavarots?
Wat is de samenstelling van een lavarots?  Verschillende aandrijfmechanismen geïdentificeerd voor ladingsvolgorde in monolaag vanadiumdiselenide
Verschillende aandrijfmechanismen geïdentificeerd voor ladingsvolgorde in monolaag vanadiumdiselenide Een nieuwe benadering om robotnavigatie in binnenomgevingen te verbeteren
Een nieuwe benadering om robotnavigatie in binnenomgevingen te verbeteren Nanokristallen die bacteriële biofilms uitroeien
Nanokristallen die bacteriële biofilms uitroeien
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

