
Wetenschap
Nieuwe studie onthult computergestuurde benadering voor het onderdrukken van kankertumorgroei
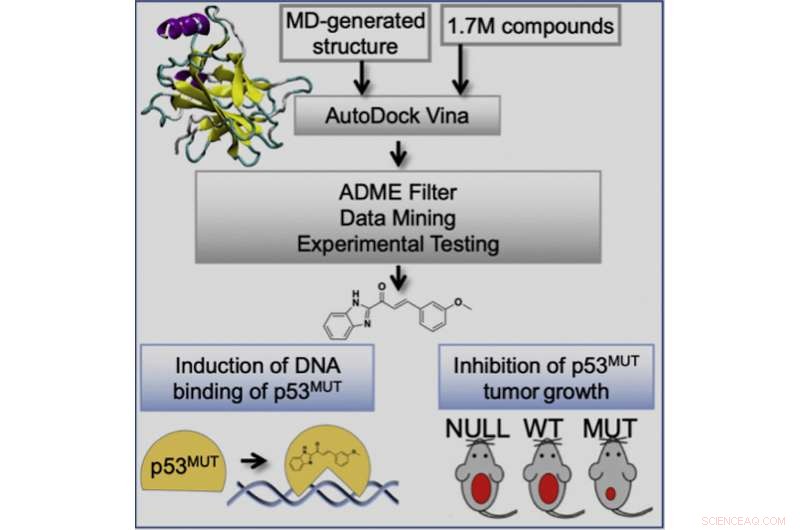
Grafisch abstract. Krediet:Geetha Durairaj et al, Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.07.003
Een nieuwe studie, geleid door onderzoekers van de Universiteit van Californië, Irvine en de Universiteit van Californië, San Diego, onthult een nieuwe computergestuurde benadering om kleine moleculen te identificeren die aspecten van de wildtype p53-tumoronderdrukkingsfunctie kunnen herstellen naar gemuteerd p53, die een belangrijke rol spelen bij veel menselijke kankers. Deze aanpak was zowel in vitro als in vivo succesvol. Deze strategie kan de chemische diversiteit van p53-correctormoleculen voor klinische ontwikkeling vergroten.
De tumorsuppressor p53 is een van de krachtigste mechanismen die organismen gebruiken om zichzelf tegen kanker te beschermen. Olifanten hebben meerdere kopieën van het p53-gen en krijgen zelden kanker. Mensen hebben slechts één kopie en het is het meest gemuteerde gen dat wordt gevonden in menselijke kanker. Diverse therapeutische benaderingen worden actief nagestreefd om dit pad aan te pakken.
"Interessant is dat een groot deel van de p53-veranderingen missense-mutaties zijn, waarbij de genetische code van de p53 wordt gewijzigd op een manier die een ander aminozuur produceert dan het normaal zou doen," verklaarde Peter Kaiser, Ph.D., professor en voorzitter van de afdeling Biologische Chemie van de UCI School of Medicine. "Dit resulteert in een overvloed aan mutante p53-eiwitniveaus in tumoren die in principe vatbaar zijn voor een correctorgeneesmiddelbenadering."
Gepubliceerd inCell Chemical Biology , de studie identificeerde kleine medicijnachtige verbindingen die werken via een goed gedefinieerde werkingswijze; vereisen geen covalente hechting, inductie van redox-onbalans of metaalbinding; en hebben selectieve antikankeractiviteiten op tumoren met p53 missense-mutaties. Dit onderzoek biedt een raamwerk voor de ontdekking van p53-reactiveringsverbindingen die kunnen helpen om de chemische diversiteit te vergroten en de farmacologische eigenschappen te verbeteren die nodig zijn voor de vertaling van farmaceutische p53-mutantreactivering naar de kliniek.
"Deze studie toont met succes de haalbaarheid en werkzaamheid aan van farmaceutische reactivering van mutant p53," zei Kaiser. "Deze bevindingen zijn bemoedigend gezien het grote aantal kankerpatiënten met p53-mutaties die baat kunnen hebben bij dergelijke medicijnen."
Deze studie omvatte de toepassing van een op ensembles gebaseerde virtuele screeningbenadering, ontwikkeld in het laboratorium van Rommie Amaro, professor en bijzonder leerstoel in de afdeling Scheikunde en Biochemie aan de UC San Diego, die het potentieel heeft om verbindingen te identificeren met een verhoogd kankerdodend potentieel en met een breed spectrum van activiteit over een panel van p53-mutanten. De onderzoekers toonden aan dat hun verbindingen mutant p53 binden en de conformatie van mutant p53 veranderen in wildtype-achtige structuren. Dit herstelt p53-DNA-bindingsactiviteit om de p53-transcriptierespons te activeren, wat op zijn beurt tumorprogressie in muismodellen voorkomt, selectief voor tumoren met een p53 missense-mutatie.
Er blijven uitdagingen om exacte mechanismen te definiëren en zeer actieve correctorgeneesmiddelen voor gemuteerd p53 te ontwikkelen en toekomstige experimenten zijn nodig om de farmacologische eigenschappen te optimaliseren om vooruitgang te boeken in de richting van klinische therapieën. + Verder verkennen
Er is meer dan één gemuteerde kopie van het PIK3CA-gen nodig om borstkanker agressiever te maken
 PH-waarden aanpassen
PH-waarden aanpassen  Activiteiten voor het onderwijzen van warme en koude temperaturen
Activiteiten voor het onderwijzen van warme en koude temperaturen  Het oplossen van een fossiel mysterie kan de zoektocht naar het leven op Mars helpen
Het oplossen van een fossiel mysterie kan de zoektocht naar het leven op Mars helpen Beeldvormingstechniek geeft katalytische 2D-materiaaltechniek een beter zicht
Beeldvormingstechniek geeft katalytische 2D-materiaaltechniek een beter zicht Wetenschappers ontwikkelen ultragevoelige organische fototransistoren op basis van nieuwe hybride gelaagde architectuur
Wetenschappers ontwikkelen ultragevoelige organische fototransistoren op basis van nieuwe hybride gelaagde architectuur
 Luchtvervuiling beïnvloedt de ontwikkeling van de hersenen, maar wanneer begint de schade?
Luchtvervuiling beïnvloedt de ontwikkeling van de hersenen, maar wanneer begint de schade? Het verminderen van vervuiling door het wegvervoer kan planten helpen groeien
Het verminderen van vervuiling door het wegvervoer kan planten helpen groeien Wetenschappers trotseren orkaan Harveys felle wind en kletterende regen - Irma is de volgende
Wetenschappers trotseren orkaan Harveys felle wind en kletterende regen - Irma is de volgende Polen zegt dat oerwoud geen UNESCO-natuurerfgoed mag zijn
Polen zegt dat oerwoud geen UNESCO-natuurerfgoed mag zijn In Yakutia, Rusland graaft naar diamanten in permafrost
In Yakutia, Rusland graaft naar diamanten in permafrost
Hoofdlijnen
- Waarom zijn cellen belangrijk voor levende organismen?
- Hoe kunnen er pitloze druiven zijn? Hoe kunnen ze zich voortplanten?
- Technologie die complexe moleculaire interacties simuleert, kan leiden tot betere behandelingen voor kanker en COVID-19
- Big data helpt onderzoekers in de strijd om plantenindringers onder controle te krijgen
- Vergelijking & identificatie van kikkers en menselijke bloedcellen
- Analyse van het potentieel van AlphaFold bij het ontdekken van geneesmiddelen
- Biologen ontdekten de paden van groepen van de lophopoor
- Structuur van het cardiovasculaire systeem
- Een konijn ontleden
- Een manier om methaan onder milde omstandigheden direct om te zetten in methanol of azijnzuur
- Wetenschappers ontdekken hoe eiwitten kristallen vormen die een microbenomhulsel betegelen
- Water beïnvloedt de plakkerigheid van hyaluronan

- Een nieuwe betaalbare en gebruiksvriendelijke technologie voor de diagnose van droge ogen

- Magnetische behandeling kan helpen bij het verwijderen van de smaak van wijnen
 Maak een lijst van de top 5 natuurlijke hulpbronnen
Maak een lijst van de top 5 natuurlijke hulpbronnen Eerste grootschalige studie belicht kunstenaarsdiversiteit in Amerikaanse musea
Eerste grootschalige studie belicht kunstenaarsdiversiteit in Amerikaanse musea Klimaatverandering kan de timing van zomeronweersbuien verschuiven
Klimaatverandering kan de timing van zomeronweersbuien verschuiven Goudgecoate schimmels zijn de nieuwe goudzoekers
Goudgecoate schimmels zijn de nieuwe goudzoekers Nieuwe Australische wetten kunnen leiden tot gevangenisstraffen voor execs van sociale media vanwege terreurbeelden
Nieuwe Australische wetten kunnen leiden tot gevangenisstraffen voor execs van sociale media vanwege terreurbeelden Voedsel buiten de vuilstort houden
Voedsel buiten de vuilstort houden Snelle radio-uitbarsting gebonden aan verre dwergstelsel, en misschien magnetar
Snelle radio-uitbarsting gebonden aan verre dwergstelsel, en misschien magnetar De overeenkomsten en verschillen tussen de zon en de maan
De overeenkomsten en verschillen tussen de zon en de maan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

