
Wetenschap
Uiterlijk van cystische fibrose op moleculaire schaal
Grafisch abstract. Krediet:DOI:10.1038/s41589-021-00844-0
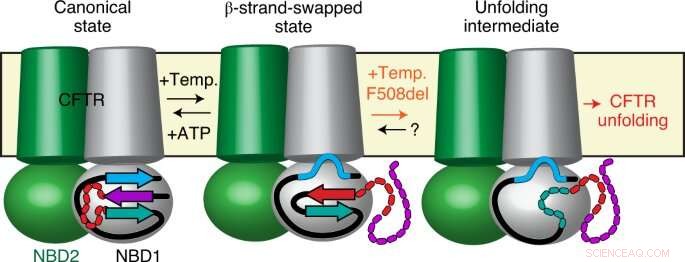
Ondanks de opmerkelijke medische vooruitgang van de laatste jaren, cystische fibrose blijft de meest voorkomende dodelijke genetische ziekte. Het is te wijten aan mutaties in het CFTR-eiwit dat normaal gesproken nodig is om de juiste vochtbalans in belangrijke organen zoals longen, alvleesklier of het spijsverteringsstelsel.
In de meeste gevallen, de oorzakelijke mutatie, genaamd F508del, omvat slechts één van de 1.480 aminozuren waaruit het CFTR-eiwit bestaat. Deze schijnbaar kleine verandering leidt tot sterke schadelijke effecten in het eiwit, die zijn normale biologische functie niet meer kan uitoefenen, leidend tot het ontstaan van de ziekte. Voor jaren, onderzoekers hebben geprobeerd te begrijpen hoe en waarom een eenvoudige mutatie zulke grote effecten op de eiwitstructuur en -functie veroorzaakt, met dramatische gevolgen voor de patiënten.
Met behulp van een combinatie van geavanceerde methoden zoals fluorescentie met één molecuul, X-ray kristallografie, waterstof-deuteriumuitwisseling en elektrofysiologie van één molecuul, onderzoekers onder leiding van Cédric Govaerts—Laboratoire Structure &Fonction des membranes biologiques, Faculteit der Wetenschappen, Université libre de Bruxelles - hebben een volledig nieuw fenomeen in CFTR ontdekt:terwijl van eiwitten wordt verwacht dat ze een enkele conformatie aannemen die een enkele biologische functie mogelijk maakt, ze hebben een nieuwe conformatie van CFTR waargenomen.
Deze structuur was nog niet eerder waargenomen en toont aan dat CFTR geen vast molecuul is, maar kan afwisselen tussen (ten minste) twee verschillende conformaties met mogelijk verschillende functies.
Verbazingwekkend, onderzoekers hebben ook waargenomen dat de meest voorkomende mutatie, F508del, heeft geen invloed op de structuren zelf, maar eerder de overgangen daartussen. Met andere woorden, ze stellen voor dat ziekteverwekkende mutaties zoals F508del dat niet kunnen, zoals eerder werd gedacht, de uiteindelijke conformatie van het eiwit verstoren, maar eerder de dynamiek, specifiek het vermogen van het eiwit om tussen verschillende toestanden in de cel uit te wisselen.
Deze observatie verandert ons begrip van CFTR-biologie en van cystische fibrose. In aanvulling, zijn fenomeen zou van toepassing kunnen zijn op andere eiwitten en zo het mogelijk maken om andere genetische ziekten te begrijpen.
 Onderzoekers ontwikkelen micro-organismen om vervuiling door PET-plastic aan te pakken
Onderzoekers ontwikkelen micro-organismen om vervuiling door PET-plastic aan te pakken Blauw licht betekent grote vooruitgang voor op perovskiet gebaseerde leds
Blauw licht betekent grote vooruitgang voor op perovskiet gebaseerde leds methaanthiol, een potentiële nieuwe grondstof in de C1-chemie
methaanthiol, een potentiële nieuwe grondstof in de C1-chemie Fluorbevattende moleculen uit celculturen
Fluorbevattende moleculen uit celculturen Onderzoek gaat naar nieuwe diepten in huidpeptide-onderzoek
Onderzoek gaat naar nieuwe diepten in huidpeptide-onderzoek
 NASA vindt tropische storm Gordons kracht ten oosten van het centrum
NASA vindt tropische storm Gordons kracht ten oosten van het centrum Insecticide en klimaatopwarming hebben invloed op insectengemeenschappen
Insecticide en klimaatopwarming hebben invloed op insectengemeenschappen Nieuwe orkaanvolgmissie van NASA op schema
Nieuwe orkaanvolgmissie van NASA op schema Isotopische samenstelling van atmosferisch sulfaat en nitraat
Isotopische samenstelling van atmosferisch sulfaat en nitraat Het gebruik van suikerrietstro voor bio-energie is een kans, maar er zijn voor- en nadelen
Het gebruik van suikerrietstro voor bio-energie is een kans, maar er zijn voor- en nadelen
Hoofdlijnen
- Hoe zijn cellen, weefsels en organen aan elkaar gerelateerd?
- De voor- en nadelen van grote oren voor vleermuissoorten
- Wilde zwijnengif veldtesten in Texas, Alabama in 2018
- Sarcodina Life Cycle
- Genoomgrootte beïnvloedt of planten invasief worden
- Wat een grote handtekening kan zeggen over je persoonlijkheid
- Koolwaterstofafbrekende schimmel geeft zijn geheimen prijs
- Het verlichten van sojabladeren kan de voedselvoorziening stimuleren
- Onderzoek onthult hoe cellen zich herbouwen na mitose
- nieuwe efficiënte, lage-temperatuurkatalysator voor waterstofproductie

- E-waste transformeren in een sterk, beschermende coating voor metaal

- Kunstmatige intelligentie identificeert optimale materiaalformule

- Verduidelijking belooft veel goeds voor het verbeteren van de duurzaamheid van materialen
- Wetenschappers stellen nieuwe elektrode voor voor efficiënte kunstmatige synthese van ammoniak

 Economist roept op tot oprichting van wereldwijde belastingdienst om ongelijkheid aan te pakken
Economist roept op tot oprichting van wereldwijde belastingdienst om ongelijkheid aan te pakken Russische Nauka-wetenschapsmodule koppelt met ISS
Russische Nauka-wetenschapsmodule koppelt met ISS Fox investeert $ 100 miljoen in online gamingplatform Caffeine
Fox investeert $ 100 miljoen in online gamingplatform Caffeine Fagen gebruiken om nieuwe antivries-eiwitten te ontdekken
Fagen gebruiken om nieuwe antivries-eiwitten te ontdekken Wat zijn de eigenschappen van rubber?
Wat zijn de eigenschappen van rubber?  Vedergewicht zuurstofontdekking opent venster op nucleaire symmetrie
Vedergewicht zuurstofontdekking opent venster op nucleaire symmetrie Culturele evolutie veroorzaakte grootschalige historische achteruitgang van grote zoogdieren in heel China
Culturele evolutie veroorzaakte grootschalige historische achteruitgang van grote zoogdieren in heel China Wetenschappers pleiten voor een betere integratie van infiltratie in landoppervlakmodellen
Wetenschappers pleiten voor een betere integratie van infiltratie in landoppervlakmodellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

