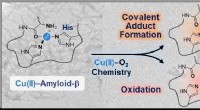
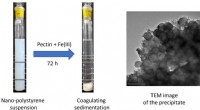
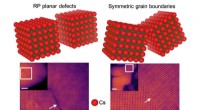
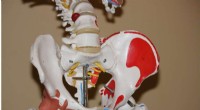
Wetenschap
Waarom is waterstofsulfide een gas bij kamertemperatuur?
Het kookpunt van een stof geeft de sterkte van zijn intermoleculaire krachten aan. Hoe sterker de intermoleculaire krachten, hoe hoger het kookpunt. Verbindingen met zwakke intermoleculaire krachten hebben lage kookpunten.
H2S heeft een relatief laag kookpunt van -60,3 °C. Dit betekent dat de intermoleculaire krachten tussen H2S-moleculen zwak zijn. Deze zwakke krachten zijn niet voldoende om H2S-moleculen bij kamertemperatuur in vloeibare of vaste toestand bij elkaar te houden. Daarom bestaat waterstofsulfide als een gas bij kamertemperatuur.
De zwakke intermoleculaire krachten in H2S zijn te wijten aan de moleculaire structuur ervan. H2S is een polair molecuul, wat betekent dat het een positief uiteinde (de waterstofatomen) en een negatief uiteinde (het zwavelatoom) heeft. De polariteit van H2S is echter niet erg sterk. Dit komt omdat het elektronegativiteitsverschil tussen waterstof en zwavel relatief klein is. Het kleine verschil in elektronegativiteit resulteert in een zwakke gedeeltelijke positieve lading op de waterstofatomen en een zwakke gedeeltelijke negatieve lading op het zwavelatoom.
De zwakke polariteit van H2S betekent dat de intermoleculaire krachten tussen H2S-moleculen zwak zijn. Dit resulteert in een laag kookpunt en het bestaan van H2S als gas bij kamertemperatuur.
 De zoektocht naar duurzame leeralternatieven
De zoektocht naar duurzame leeralternatieven Wat is de aard van een waterige oplossing van borax?
Wat is de aard van een waterige oplossing van borax?  Wat gebeurt er wanneer pepsine met voedsel in de maag wordt vermengd?
Wat gebeurt er wanneer pepsine met voedsel in de maag wordt vermengd?  Factoren die van invloed zijn op RF-waarden in dunne-laagchromatografie
Factoren die van invloed zijn op RF-waarden in dunne-laagchromatografie Wat is het resultaat van het toevoegen van loodnitraat aan kaliumjodide?
Wat is het resultaat van het toevoegen van loodnitraat aan kaliumjodide?
 De gezondheid van koraalriffen in het grootste beschermde zeegebied ter wereld
De gezondheid van koraalriffen in het grootste beschermde zeegebied ter wereld Dit is het moment om vragen te beantwoorden over de gevolgen van klimaatverandering voor ziekten
Dit is het moment om vragen te beantwoorden over de gevolgen van klimaatverandering voor ziekten Hoe kom je van Stucco-etende vogels
Hoe kom je van Stucco-etende vogels Onomkeerbaar warmer en droger klimaat boven Oost-Azië
Onomkeerbaar warmer en droger klimaat boven Oost-Azië Afbeelding:harde wind, warm weer blijft branden in Californië aanwakkeren
Afbeelding:harde wind, warm weer blijft branden in Californië aanwakkeren
Hoofdlijnen
- Elite prestatiepaarden zijn topsporters. Hoe je ze ethisch kunt trainen
- Oude microben bieden aanwijzingen voor hoe complex het leven is geëvolueerd
- Afwijkende hyfen veroorzaakt door immuunreacties van de gastheer op plantpathogene schimmel
- Nieuw inzicht in hoe de krachtcentrale van cellen zich deelt
- Wat is het verschil tussen gametogenese bij vrouwelijke zoogdieren en mannelijke zoogdieren?
- Op welke drie manieren krijgen protistische heterotrofen voedsel?
- Hoe ontwikkelen pathogenen nieuwe virulentie-activiteiten, en waarom doet dat ertoe?
- Hoe de cellen van planten, dieren en eencellige organismen te vergelijken
- Tropische vogel waarschijnlijk uit koers geblazen door orkaan Jose
 Nieuw onderzoek identificeert dodelijk verborgen weersgevaar dat miljoenen mensen kan treffen
Nieuw onderzoek identificeert dodelijk verborgen weersgevaar dat miljoenen mensen kan treffen Astronomen veroorzaken 40% meer CO2-uitstoot dan de gemiddelde Australiër. Hier ziet u hoe ze kunnen verbeteren
Astronomen veroorzaken 40% meer CO2-uitstoot dan de gemiddelde Australiër. Hier ziet u hoe ze kunnen verbeteren  Voorzichtig natuurbehoud:Hoe ervoor te zorgen dat het vertragen van de opwarming van de aarde de biodiversiteit zal beschermen
Voorzichtig natuurbehoud:Hoe ervoor te zorgen dat het vertragen van de opwarming van de aarde de biodiversiteit zal beschermen  Een langere heads-up krijgen over El Nino
Een langere heads-up krijgen over El Nino China praat over technische bekwaamheid in het licht van Amerikaanse rivaliteit
China praat over technische bekwaamheid in het licht van Amerikaanse rivaliteit Octobot is een squishy,
Octobot is een squishy,  Politiek activisme van de CEO:werkzoekenden willen bazen die een standpunt innemen
Politiek activisme van de CEO:werkzoekenden willen bazen die een standpunt innemen Nature or nurture:zit geweld in onze genen?
Nature or nurture:zit geweld in onze genen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com