
Wetenschap
Coördinatiechemie en de ziekte van Alzheimer
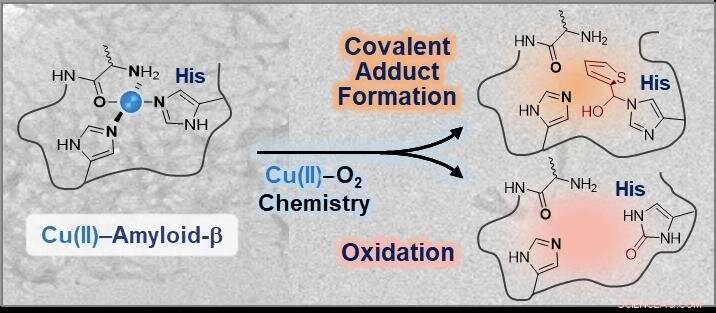
Chemische modificaties van de coördinatiesfeer in Cu(II)-amyloïde-β met behulp van koper-O2-chemie. Krediet:KAIST
Recent is duidelijk geworden dat de interacties tussen koper en amyloïde-β neurotoxische effecten hebben op de hersenen van patiënten met de ziekte van Alzheimer. KAIST-onderzoekers hebben een nieuwe strategie gerapporteerd om de neurotoxiciteit bij de ziekte van Alzheimer te veranderen door gebruik te maken van een rationeel ontworpen chemisch reagens.
Deze strategie, ontwikkeld door professor Mi Hee Lim van de afdeling Scheikunde, kan de coördinatiesfeer van koper gebonden aan amyloïde-β wijzigen, het effectief remmen van de binding van koper aan amyloïde-β en het veranderen van de aggregatie en toxiciteit ervan. Hun studie was te zien in PNAS vorige maand.
De onderzoekers ontwikkelden een klein molecuul dat direct kan interageren met de coördinatiesfeer van koper-amyloïde-β-complexen, gevolgd door modificaties via ofwel covalente conjugatie, oxidatie, of beide onder aerobe omstandigheden. Het onderzoeksteam gebruikte eenvoudigweg koper-dizuurstofchemie om een chemisch reagens te ontwerpen.
Het blijft een hele uitdaging om te beantwoorden hoe peptide-modificaties door een klein molecuul plaatsvinden. Het systeem omvat overgangsmetalen en amyloïdogene eiwitten en is vrij heterogeen, omdat ze voortdurend worden gewijzigd. Het is van cruciaal belang om de meerdere variabelen, zoals de aanwezigheid van dizuurstof en het type overgangsmetaalionen en amyloïdogene eiwitten, zorgvuldig te controleren om de onderliggende mechanismen en doelspecificiteit van het chemische reagens te identificeren.
Het onderzoeksteam gebruikte verschillende biofysische en biochemische methoden om de mechanismen voor modificaties op de coördinatiesfeer van koper-Aβ-complexen te bepalen. Onder hen, peptidemodificaties werden voornamelijk geanalyseerd met behulp van elektrospray-ionisatie-massaspectrometrie.
Massaspectrometrie (MS) is toegepast om dergelijke peptidemodificaties te verifiëren door de verschuiving in exacte massa te berekenen. Het onderzoeksteam voerde ook botsingsgeïnduceerde dissociatie (CID) uit van het door MS gedetecteerde doelion om vast te stellen welk aminozuurresidu specifiek is gemodificeerd. De CID fragmenteert de amidebinding die zich tussen de aminozuurresten bevindt. Deze fragmentanalyse stelt ons in staat om de specifieke plaatsen van peptidemodificaties te identificeren.

Professor Lim(links) en promovendus Han. Krediet:het Korea Advanced Institute of Science and Technology (KAIST)
De koper- en amyloïde-β-complexen vertegenwoordigen een pathologisch verband tussen metaalionen en amyloïde-β bij de ziekte van Alzheimer. Recente bevindingen geven aan dat koper en amyloïde-β direct kunnen bijdragen aan neurodegeneratie door toxische amyloïde-β-oligomeren en reactieve zuurstofsoorten te produceren.
Professor Lim zei:"Deze studie illustreert het eerste experimentele bewijs dat het 14e histidine-residu in koper-amyloïde-β-complexen specifiek kan worden gemodificeerd door covalente conjugatie, oxidatie, of allebei. Gezien de neurotoxische implicaties van de interacties tussen koper en amyloïde-β, dergelijke modificaties op de coördinatiesfeer van koper in amyloïde-β zouden de eigenschappen en toxiciteit ervan effectief kunnen veranderen."
"Deze multidisciplinaire studie met de nadruk op benaderingen, reactiviteiten, en mechanismen kijken uit naar het openen van een nieuwe manier om kandidaten voor anti-neurodegeneratieve ziekten te ontwikkelen, " voegde ze eraan toe. De National Research Foundation of Korea financierde dit onderzoek.
 Dieren die infraroodlicht kunnen zien
Dieren die infraroodlicht kunnen zien Toewijding aan democratische waarden voorspellen bezorgdheid over klimaatverandering
Toewijding aan democratische waarden voorspellen bezorgdheid over klimaatverandering De kobaltafzettingen op aarde werden veel later gevormd dan eerder werd aangenomen
De kobaltafzettingen op aarde werden veel later gevormd dan eerder werd aangenomen Voorbij windsnelheid - Een nieuwe maatstaf voor het voorspellen van orkaaneffecten
Voorbij windsnelheid - Een nieuwe maatstaf voor het voorspellen van orkaaneffecten De temperatuur van het zeeoppervlak heeft een grote invloed op de overleving van koraal outplants
De temperatuur van het zeeoppervlak heeft een grote invloed op de overleving van koraal outplants
Hoofdlijnen
- Uitgebreide quota voor blauwvintonijn kunnen het herstel ongedaan maken:wetenschappers
- Elektronenmicroscoopbeelden laten zien hoe cellen een vitaal mineraal opnemen
- Geboortebeperking voor parasieten:onderzoekers onthullen nieuw vaccindoelwit voor malaria
- Bladcelstructuur
- Differentiëren van RNA- en DNA-virussen
- De centrale hoek vinden
- Wat is het Human Epigenome Project?
- Hoe een hart voor een wetenschapsproject te bouwen
- Lijst met toepassingen van elektroforese
- Onderzoekers produceren filamenten en vezels die drie keer fijner zijn dan een mensenhaar
- Voedsel- en drugsvervalsingen en fraude doorzien

- Unieke chemie - die ooit zou kunnen helpen bij het bestrijden van ernstige ziekten - gevonden in de Nieuw-Zeelandse glimworm

- Nieuwe aanpak kan autoriteiten helpen sneller te reageren op radiologische dreigingen in de lucht

- Een nieuw regime voor het analyseren van eigenschappen van topologische materialen

 Sensor gebruikt bij CERN kan jagers op zwaartekrachtgolven helpen
Sensor gebruikt bij CERN kan jagers op zwaartekrachtgolven helpen Een nieuwe plasmamotor zal minder dure, efficiënter, en langere ruimtemissies
Een nieuwe plasmamotor zal minder dure, efficiënter, en langere ruimtemissies Hubbles op de eerste rij wanneer sterrenstelsels botsen
Hubbles op de eerste rij wanneer sterrenstelsels botsen Onderzoekers schijnen licht op de defecten die verantwoordelijk zijn voor rommelig gedrag in kwantummaterialen
Onderzoekers schijnen licht op de defecten die verantwoordelijk zijn voor rommelig gedrag in kwantummaterialen Is er een verband tussen giraal betalen en ongezonde consumptie?
Is er een verband tussen giraal betalen en ongezonde consumptie? Glycanen zijn cruciaal bij COVID-19-infectie
Glycanen zijn cruciaal bij COVID-19-infectie Zwitserse kiezers steunen spionage verzekeringsmaatschappij
Zwitserse kiezers steunen spionage verzekeringsmaatschappij Methode biedt goedkope beeldvorming op de schaal van virusdeeltjes
Methode biedt goedkope beeldvorming op de schaal van virusdeeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

