
Wetenschap
Waarom is CsF beter oplosbaar in water dan CsI?
1. Ionische grootte:De ionische grootte van het fluoride-ion (F-) is kleiner in vergelijking met het jodide-ion (I-). De kleinere omvang van het F-ion zorgt voor sterkere elektrostatische interacties met de polaire watermoleculen, wat leidt tot een betere solvatatie en dus een hogere oplosbaarheid.
2. Hydratatie-energie:De hydratatie-energie van CsF is groter dan die van CsI. Hydratatie-energie verwijst naar de energie die vrijkomt wanneer ionen worden omringd door watermoleculen. Vanwege de kleinere omvang en hogere ladingsdichtheid van het F-ion kan het effectiever interageren met watermoleculen, waardoor meer hydratatie-energie vrijkomt en dit resulteert in een hogere oplosbaarheid.
3. Roosterenergie:Roosterenergie is de energie die nodig is om ionen van een kristalrooster te scheiden. Over het algemeen zijn verbindingen met lagere roosterenergieën doorgaans beter oplosbaar. CsF heeft een lagere roosterenergie vergeleken met CsI, waardoor het voor de Cs+- en F--ionen gemakkelijker wordt om te dissociëren en op te lossen in water.
4. Polariseerbaarheid:Polariseerbaarheid meet het vermogen van een ion om zijn elektronenwolk te vervormen als reactie op een extern elektrisch veld. Het jodide-ion (I-) is beter polariseerbaar dan het fluoride-ion (F-), wat betekent dat het gemakkelijker kan vervormen in water. Deze verhoogde polariseerbaarheid vermindert de elektrostatische interacties tussen I- en Cs+-ionen, wat leidt tot zwakkere ionische bindingen en een lagere oplosbaarheid.
Samenvattend is de hogere oplosbaarheid van CsF vergeleken met CsI voornamelijk te wijten aan de kleinere ionische grootte, grotere hydratatie-energie, lagere roosterenergie en lagere polariseerbaarheid van het fluoride-ion (F-) vergeleken met het jodide-ion (I-).
 Hoe u kunt voorkomen dat u de wereld opeet:van degrowth naar een duurzame transformatie van het voedselsysteem
Hoe u kunt voorkomen dat u de wereld opeet:van degrowth naar een duurzame transformatie van het voedselsysteem Onderzoekers gebruiken met succes gedistribueerde akoestische detectie voor seismische monitoring
Onderzoekers gebruiken met succes gedistribueerde akoestische detectie voor seismische monitoring Braziliaanse officier van justitie beveelt aan om Total-olievergunning in de buurt van Amazon te weigeren
Braziliaanse officier van justitie beveelt aan om Total-olievergunning in de buurt van Amazon te weigeren Hoe een droogte bomen beïnvloedt, hangt af van wat hen tegenhoudt
Hoe een droogte bomen beïnvloedt, hangt af van wat hen tegenhoudt  Het modelleren van oude Antarctische ijskappen helpt ons de toekomst van de opwarming van de aarde te zien
Het modelleren van oude Antarctische ijskappen helpt ons de toekomst van de opwarming van de aarde te zien
Hoofdlijnen
- Bijen gebruiken patronen, niet alleen kleuren, om bloemen te vinden
- Prehistorische vrouwen waren sterker dan de elite vrouwelijke atleten van vandaag
- Nieuwsgierige grote witte haai speelt met camera
- Het belang van DNA in de menselijke cel
- Waarom is ATP nodig om het lichaam normaal te laten functioneren?
- Kunnen we samenwerken met onze bacteriën om infecties te stoppen?
- Kan artrose het humeur van een hond beïnvloeden?
- Een aangepast model dat is ontworpen om kernsplijting te simuleren, werpt licht op hoe geruchten beginnen, zich verspreiden en eindigen
- Vrouwelijke mangoesten helpen hun pups door rivalen te verdrijven
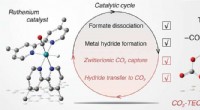
- Monitoring van tussenproducten in CO2-conversie naar formiaat door metaalkatalysator
- Nieuwe hulpmiddelen om bioactieve lipiden te bestuderen

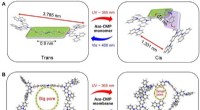
- Microporeuze polymeermembranen voor licht-gated ionentransport
- Hoe we de vroegste glasproductie ten zuiden van de Sahara vonden, en wat het betekent

- Weet jij de weg naar Berkelium, Californië?

 Een lang verborgen geheim vinden in Paradise Lost
Een lang verborgen geheim vinden in Paradise Lost Studie vindt miljard-jarige superocean-cycli in de geschiedenis van de aarde
Studie vindt miljard-jarige superocean-cycli in de geschiedenis van de aarde dunne lens met variabele focus, ontworpen voor augmented en virtual reality-headsets
dunne lens met variabele focus, ontworpen voor augmented en virtual reality-headsets NASA volgt een gefragmenteerde, zwakkere tropische storm Hector in noordwestelijke Stille Oceaan
NASA volgt een gefragmenteerde, zwakkere tropische storm Hector in noordwestelijke Stille Oceaan Een gas met een volume van 4,00 liter bij een druk van 205 kPa mag 12,0 liter uitzetten. Wat gebeurt er in de container als de temperatuur constant blijft?
Een gas met een volume van 4,00 liter bij een druk van 205 kPa mag 12,0 liter uitzetten. Wat gebeurt er in de container als de temperatuur constant blijft?  Hoe eiwitaggregatie plaatsvindt in cellen
Hoe eiwitaggregatie plaatsvindt in cellen Wat is de functie van gaschromatograaf?
Wat is de functie van gaschromatograaf?  Kaasachtig luisteren:onderzoek zegt dat deuntjes de smaak van Emmental veranderen
Kaasachtig luisteren:onderzoek zegt dat deuntjes de smaak van Emmental veranderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

