
Wetenschap
Welk type atomen vormen doorgaans een ionische binding?
Atomen die doorgaans ionische bindingen vormen, zijn onder meer:
1. Alkalimetalen (Groep 1):Deze elementen hebben een lage elektronegativiteit en verliezen gemakkelijk hun buitenste elektron om positieve ionen (kationen) te vormen. Voorbeelden zijn onder meer lithium (Li), natrium (Na) en kalium (K).
2. Aardalkalimetalen (Groep 2):Net als alkalimetalen hebben aardalkalimetalen een lage elektronegativiteit en verliezen ze gemakkelijk hun twee buitenste elektronen om positieve ionen te vormen. Voorbeelden hiervan zijn calcium (Ca), magnesium (Mg) en strontium (Sr).
3. Halogenen (Groep 17):Halogenen hebben een hoge elektronegativiteit en trekken sterk elektronen van andere atomen aan. Ze verwerven gemakkelijk één elektron om een stabiele elektronenconfiguratie te bereiken en negatieve ionen (anionen) te vormen. Voorbeelden zijn onder meer fluor (F), chloor (Cl) en broom (Br).
4. Zuurstof en zwavel (groep 16):Zuurstof en zwavel hebben een hoge elektronegativiteit en kunnen negatieve ionen vormen door elektronen te winnen uit meer elektropositieve elementen. Ze vormen vaak ionische bindingen met metalen.
Over het algemeen treden ionische bindingen op als er een groot elektronegativiteitsverschil bestaat tussen een metaal en een niet-metaal. Het metaal verliest elektronen aan het niet-metaal, wat resulteert in de vorming van positief geladen metaalionen en negatief geladen niet-metaalionen. Deze tegengesteld geladen ionen worden vervolgens bij elkaar gehouden door elektrostatische krachten om een ionische verbinding te vormen.
 Orkanen kunnen leiden tot veerkracht - goed nieuws volgt slecht nieuws voor de tropische bossen van Puerto Rico
Orkanen kunnen leiden tot veerkracht - goed nieuws volgt slecht nieuws voor de tropische bossen van Puerto Rico Zullen tornado's en waterhozen gedijen als de aarde opwarmt?
Zullen tornado's en waterhozen gedijen als de aarde opwarmt?  Hoe het proces van condensatie uit te leggen
Hoe het proces van condensatie uit te leggen Wat is de Tree Equity-score van uw stad?
Wat is de Tree Equity-score van uw stad?  2017 wordt het heetste niet-El Nino-jaar:UN
2017 wordt het heetste niet-El Nino-jaar:UN
Hoofdlijnen
- Decodering van hondencognitie:machine learning geeft een glimp van hoe het brein van een hond vertegenwoordigt wat het ziet
- Nieuwe onderzoeksaanpak:onderzoek naar het mondgevoel van voedsel met een microscoop
- Is een stoel biotische of abiotische factor?
- Theory of Evolution: Definition, Charles Darwin, Evidence & Voorbeelden
- Oudste chimpansee van bekende Guinese groep sterft
- Studie geeft inzicht in hoe algen kooldioxide uit de lucht zuigen
- Het ontsluiten van de geheimen van hoe cellen communiceren biedt inzichten in de behandeling van ziekten
- Zouden mensen bereid zijn hun persoonsgegevens af te staan voor onderzoek?
- Wat is het kernmembraan en wat doet het?
- Hoe robotwiskunde en smartphones onderzoekers naar een doorbraak in de ontdekking van medicijnen hebben geleid

- Polymeren te hulp! Cellen beschermen tegen beschadiging van ijs
- Gerookt voedsel is lekkerder, minder schadelijk met een tip van de auto-industrie

- Afval omzetten in biobased chemicaliën

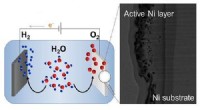
- Water splitsen voor de prijs van een nikkel
 Een recordaantal van 1.101 zeekoeien uit Florida stierven in 2021. Wanneer stopt het?
Een recordaantal van 1.101 zeekoeien uit Florida stierven in 2021. Wanneer stopt het? Honden met actievere eigenaren kunnen meer beweging krijgen
Honden met actievere eigenaren kunnen meer beweging krijgen Eerste draadloze transceiver op millimeterschaal voor elektronische pillen
Eerste draadloze transceiver op millimeterschaal voor elektronische pillen Rusland vindt ISS-gat dat opzettelijk is gemaakt:ruimtechef
Rusland vindt ISS-gat dat opzettelijk is gemaakt:ruimtechef Theoretisch bewijs dat een sterke kracht lichtgewicht subatomaire deeltjes kan creëren
Theoretisch bewijs dat een sterke kracht lichtgewicht subatomaire deeltjes kan creëren Wat zijn de beste levensomstandigheden? Het verkennen van het multiversum kan ons helpen erachter te komen
Wat zijn de beste levensomstandigheden? Het verkennen van het multiversum kan ons helpen erachter te komen  Veroorzaken maanfasen grote aardbevingen? Studie ontkracht dat idee
Veroorzaken maanfasen grote aardbevingen? Studie ontkracht dat idee  De voordelen zijn waarschijnlijk groter dan de kosten voor nationale monumenten in het Amerikaanse Westen
De voordelen zijn waarschijnlijk groter dan de kosten voor nationale monumenten in het Amerikaanse Westen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

