
Wetenschap
Beschrijf wat er wordt bedoeld als water een polair molecuul wordt genoemd?
Water wordt een polair molecuul genoemd omdat de zuurstof- en waterstofatomen verschillende elektronegativiteiten hebben, wat betekent dat ze elektronen in verschillende mate aantrekken. Dit resulteert in een lichte positieve lading op de waterstofatomen en een lichte negatieve lading op het zuurstofatoom, waardoor een polaire covalente binding ontstaat. De ongelijke verdeling van elektronen in het watermolecuul creëert een netto positief en negatief uiteinde, waardoor het polariteit krijgt. Door deze polariteit kunnen watermoleculen waterstofbruggen met elkaar vormen, waarbij de positieve waterstofatomen van het ene watermolecuul worden aangetrokken door de negatieve zuurstofatomen van een ander watermolecuul. Deze waterstofbruggen zijn verantwoordelijk voor de unieke eigenschappen van water, zoals de hoge oppervlaktespanning, het hoge kookpunt en het vermogen om als universeel oplosmiddel te fungeren.
 Zijn bladeren een katalysator voor vuur?
Zijn bladeren een katalysator voor vuur?  Onderzoekers onderzoeken hoe de drijvende krachten achter de klimaatverandering de methaan- en lachgascycli in de oceaan hervormen
Onderzoekers onderzoeken hoe de drijvende krachten achter de klimaatverandering de methaan- en lachgascycli in de oceaan hervormen  IJsbindende moleculen stoppen ijsgroei, fungeren als natuurlijke antivries
IJsbindende moleculen stoppen ijsgroei, fungeren als natuurlijke antivries Wat zijn de toepassingen van chemie in de landbouw?
Wat zijn de toepassingen van chemie in de landbouw?  Hoe formules voor ionische verbindingen te schrijven
Hoe formules voor ionische verbindingen te schrijven
 Wetenschappers navigeren door de paradox van extreem koude gebeurtenissen in een opwarmende wereld
Wetenschappers navigeren door de paradox van extreem koude gebeurtenissen in een opwarmende wereld  Een schijnbaar symbolische actie veranderde het debat over klimaatverandering
Een schijnbaar symbolische actie veranderde het debat over klimaatverandering Orkaan Irma trekt over grote steden in Florida
Orkaan Irma trekt over grote steden in Florida De verschillende soorten landvormen
De verschillende soorten landvormen  Kaapstad bezuinigt om de ergste droogte in 100 jaar te overleven
Kaapstad bezuinigt om de ergste droogte in 100 jaar te overleven
Hoofdlijnen
- Herziening van historische voorraadroutes kan zeldzame stukken inheemse planten en dieren in gevaar brengen
- Hoe kakkerlakken zich over de hele wereld verspreiden en een plaag worden, weten we vandaag de dag
- Acht nieuwe soorten kleine gekko's tuimelen uit de regenwouden van Madagaskar
- Hoe een onbekende bacterie in de microbiologie te identificeren
- Wetenschappers vinden ontbrekende aanwijzing over hoe hiv cellen hackt om zichzelf te verspreiden
- Welke soorten organische moleculen vormen een celmembraan?
- Onderzoekers testen probiotica in voeding en supplementen
- Wat is het Forer-effect?
- Welke mogelijke gameet kan de plant produceren?
- Studie innoveert in glutenvrije formuleringen, smakelijker en voedzamer brood creëren

- Laboratoriumtests tonen aan dat molecuul celdood in tumoren lijkt te stimuleren, ontsteking
- Een niet-giftige lijm voor triplex—van glucose, citroenzuur

- Moleculaire modelleringskit ter grootte van een micrometer toont echte chemische reacties

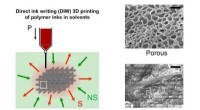
- Onderzoekers ontwikkelen een unieke methode om 3D poreuze structuren te fabriceren
 Waarom wordt bier skunky?
Waarom wordt bier skunky?  PaintBot:een diep lerende student die traint en vervolgens oude meesters nabootst
PaintBot:een diep lerende student die traint en vervolgens oude meesters nabootst Stabiliteit van de grootste ijsklomp op aarde die gevaar loopt door opwarmende oceanen
Stabiliteit van de grootste ijsklomp op aarde die gevaar loopt door opwarmende oceanen Europa's verloren bossen - onderzoek toont aan dat de dekking in zes millennia is gehalveerd
Europa's verloren bossen - onderzoek toont aan dat de dekking in zes millennia is gehalveerd Heeft Nostradamus voorspellingen gedaan over 2012?
Heeft Nostradamus voorspellingen gedaan over 2012?  Is het helpen van een slecht persoon niet goed of slecht?
Is het helpen van een slecht persoon niet goed of slecht? In een nieuwe studie wordt naar de Amerikaanse Drought Monitor gekeken om te zien hoe deze de klimaatverandering sinds 2000 heeft weerspiegeld
In een nieuwe studie wordt naar de Amerikaanse Drought Monitor gekeken om te zien hoe deze de klimaatverandering sinds 2000 heeft weerspiegeld  Wie zijn de klimaatactivisten die kunst en musea vernielen, waarom?
Wie zijn de klimaatactivisten die kunst en musea vernielen, waarom?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

