
Wetenschap
Computationeel onderzoek onthult hoe Ebola-nucleocapside stabiliseert
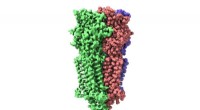
Eerdere studies hebben aangetoond dat de NP van het Ebola-virus een zeer dynamisch eiwit is dat tijdens zijn levenscyclus een aantal conformationele veranderingen ondergaat. De moleculaire mechanismen die ten grondslag liggen aan deze conformationele veranderingen worden echter niet volledig begrepen.
In een recente studie gebruikten onderzoekers van de Universiteit van Texas in Austin computationele methoden om de structurele dynamiek van het Ebola-virus NP te onderzoeken. Uit hun bevindingen blijkt dat het NP wordt gestabiliseerd door een netwerk van waterstofbruggen en zoutbruggen tussen de verschillende domeinen. Dit netwerk van interacties helpt de NP in zijn functionele conformatie te houden en voorkomt dat deze zich ontvouwt.
De onderzoekers ontdekten ook dat de NP gevoelig is voor proteolytische splitsing door het gastheerprotease furine. Furinesplitsing van de NP veroorzaakt een aantal conformationele veranderingen in het eiwit die leiden tot de afgifte van het virale RNA uit het nucleocapside.
Deze bevindingen bieden nieuwe inzichten in de moleculaire mechanismen die de conformationele dynamiek van het Ebola-virus NP reguleren. Deze informatie zou kunnen worden gebruikt om nieuwe therapeutische strategieën te ontwikkelen om de NP te targeten en de replicatie van het virus te voorkomen.
De studie werd gepubliceerd in het tijdschrift "The Journal of Physical Chemistry B".
 Nieuwe macrolacton-database kan helpen bij het ontdekken van medicijnen, Onderzoek
Nieuwe macrolacton-database kan helpen bij het ontdekken van medicijnen, Onderzoek Een TRAP instellen voor pandemische virussen
Een TRAP instellen voor pandemische virussen De natuur heeft meer dan één manier om methaan te maken, zeggen biochemici
De natuur heeft meer dan één manier om methaan te maken, zeggen biochemici De groei van nanodeeltjes belichten met röntgenstralen
De groei van nanodeeltjes belichten met röntgenstralen Efficiëntere fotokatalysatoren kunnen het potentieel van zonne-energie ontsluiten
Efficiëntere fotokatalysatoren kunnen het potentieel van zonne-energie ontsluiten
 Nieuwe studie toont aan dat bosbranden in Victoria in omvang en frequentie toenemen
Nieuwe studie toont aan dat bosbranden in Victoria in omvang en frequentie toenemen Oost-Aziatische warmwaterbron gekoppeld aan de anomalie van de oppervlaktetemperatuur van de Atlantische Oceaan
Oost-Aziatische warmwaterbron gekoppeld aan de anomalie van de oppervlaktetemperatuur van de Atlantische Oceaan Onderzoeker scherpt model aan om stoffige omstandigheden maanden van tevoren te voorspellen
Onderzoeker scherpt model aan om stoffige omstandigheden maanden van tevoren te voorspellen Hoe de gewone fruitvlieg de zon gebruikt om te navigeren
Hoe de gewone fruitvlieg de zon gebruikt om te navigeren  Wetenschappers ademen koeien uit om methaanuitstoot te meten
Wetenschappers ademen koeien uit om methaanuitstoot te meten
Hoofdlijnen
- Hoe de lengte van DNA-fragmenten te berekenen
- Wat voor soort Allele slaat een generatie over?
- Wat betekent Kaukasisch echt?
- Waarom witte honden dat zijn
- 3D-eiwitmodellering suggereert waarom COVID-19 sommige dieren infecteert, maar andere niet
- Onderzoek naar roodrugspinnen vindt dat schijnbaar weerzinwekkende paringsstrategie zowel mannen als vrouwen ten goede komt
- Hoe elektroconvulsietherapie werkt
- Onderzoekers ontdekken dat het koelen of aan de lucht drogen van bodemmonsters voor toekomstig onderzoek belangrijke microbiële details behoudt
- Aten de mensen in de oudheid een Paleo-dieet?
- Cryo-EM onthult structuur en mechanisme van de 5-HT3-receptor
- Nanopore onthult vormveranderend enzym gekoppeld aan katalyse
- De nieuwe analysemethode in een record high-speed DNA-assayapparaat

- Nieuw onderzoek onthult de geheimen van fotosynthese die zouden kunnen helpen bij de ontwikkeling van computertechnologie

- Nieuwe methode om olie uit water te verwijderen

 Studie onthult oorsprong van beweging van de oceaan in de Straat van Florida
Studie onthult oorsprong van beweging van de oceaan in de Straat van Florida Snapchat onthult nieuwe originele shows onder eigen merk
Snapchat onthult nieuwe originele shows onder eigen merk Heliumdruppeltjes vangen de dubbele waterstructuur op
Heliumdruppeltjes vangen de dubbele waterstructuur op  Drijfzand, kruipende gronden, en een nieuw begrip van landschapsevolutie
Drijfzand, kruipende gronden, en een nieuw begrip van landschapsevolutie Studie:eigenlijk potplanten verbeteren de luchtkwaliteit binnenshuis niet
Studie:eigenlijk potplanten verbeteren de luchtkwaliteit binnenshuis niet Moeten we tijdens een hittegolf allemaal naar het land vluchten?
Moeten we tijdens een hittegolf allemaal naar het land vluchten?  Welke soorten primaire consumenten bevinden zich in het naaldbos?
Welke soorten primaire consumenten bevinden zich in het naaldbos?  Wetenschappers ontdekken een nieuwe manier om massa-extincties te vinden
Wetenschappers ontdekken een nieuwe manier om massa-extincties te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

